Panaeolus cinctulus (Bolton) Sacc., Syll. fung. (Abellini) 5: 1124 (1887)
Basionimo: Agaricus cinctulus Bolton, Hist. fung. Halifax, App. (Huddersfield): 152 (1792) [1791]
Sinonimi: Agaricus cinctulus Bolton, Hist. fung. Halifax, App. (Huddersfield): 152 (1792) [1791]
Agaricus fimicola var. cinctulus (Bolton) Cooke, Forsch. PflKr., Tokyo: 221 (1883)
Coprinus cinctulus (Bolton) Gray, Nat. Arr. Brit. Pl. (London) 1: 633 (1821)
Panaeolus dunensis Bon & Courtec., in Bon, Docums Mycol. 13(no. 50): 28 (1983)
Panaeolus fimicola var. cinctulus (Bolton) Rea, Brit. basidiomyc. (Cambridge): 372 (1922)
Diagnosi originale
Agaricus stipitatus, pileo convexo, fulvo, cincto uno obscuro picto, lamellis trifidis latus nigrus, stipite longo, fistuloso fusco.BELTED AGARIC. TAB. CLII. The root is small, round, hard, firm, and furnished with numerous fibres. The stem is cylindrical, tall, of a dull fuscous colour, both within and without; it is hollow, and splits in long brown filaments. The gills are arranged in three series; they are very broad in the middle, and diminish on each extremity; the colour is a dusky black, the substance tender and brittle. The pileus is convex; it is a kind of red deer colour, with a broad belt of a dark brown, which colour is not only on the surface, but penetrates the whole substance of the pileus, as is shown in the half figure on the plate. In young plants the marginal light circle is wanting, as the smallest figure represents. Grows on dunghills, after rain, in June and July. I gathered the specimen, here figured and described, June the 25th, 1789.
Posizione sistematica: Incertae sedis, Agaricales, Agaricomycetidae, Agaricomycetes, Agaricomycotina, Basidiomycota, Fungi
Descrizione macroscopica della raccolta
Pileo diametro fino a 30 mm, all'inizio emisferico quindi convesso, infine piano-convesso, con basso umbone ottuso, margine intero, non striato e privo di residui anulari. Cuticola igrofana, liscia o appena grinzosa, coccardata, di colore ocraceo-rossiccio al disco, tendente a schiarire all'ocra chiaro in una fascia mediana, contornata da cornice marginale più o meno dello stesso colore del disco o più scura.
Lamelle fitte, alte, adnate, intercalate da 1-3 lamellule, leggermente maculate, grigiastre con sfumature ocracee, filo lamellare leggermente più chiaro, forforoso.
Stipite fino a 80 x 3-5 mm, diritto, cilindrico, leggermente allargato alla base, fistoloso, striato all'estremo margine, finemente pruinoso per buona parte della superfice rimanente, bianco, poi nocciola, sovente con riflessi aranciati.
Carne biancastra, presto a riflessi aranciati, inodore.
Descrizione microscopica della raccolta
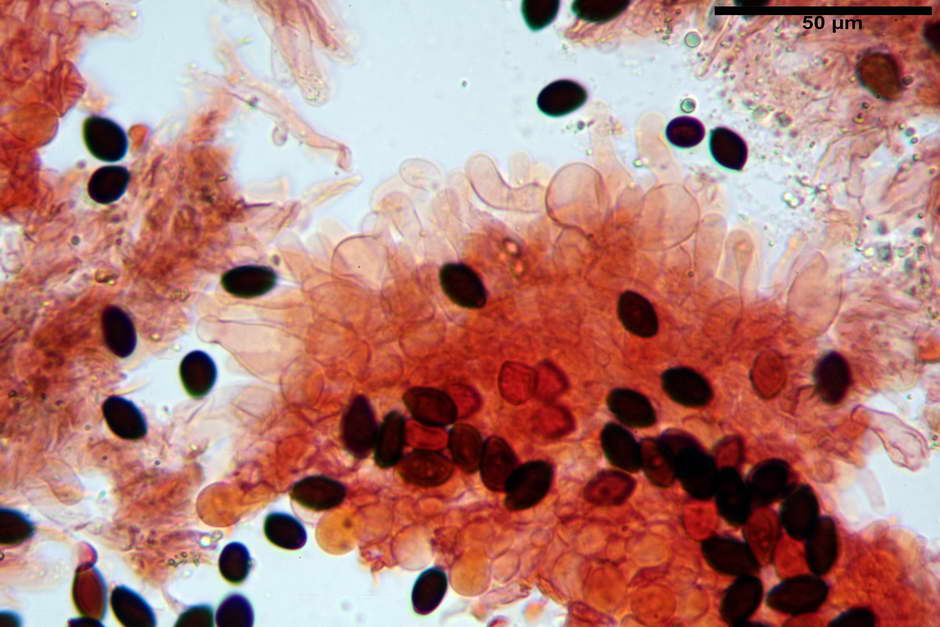
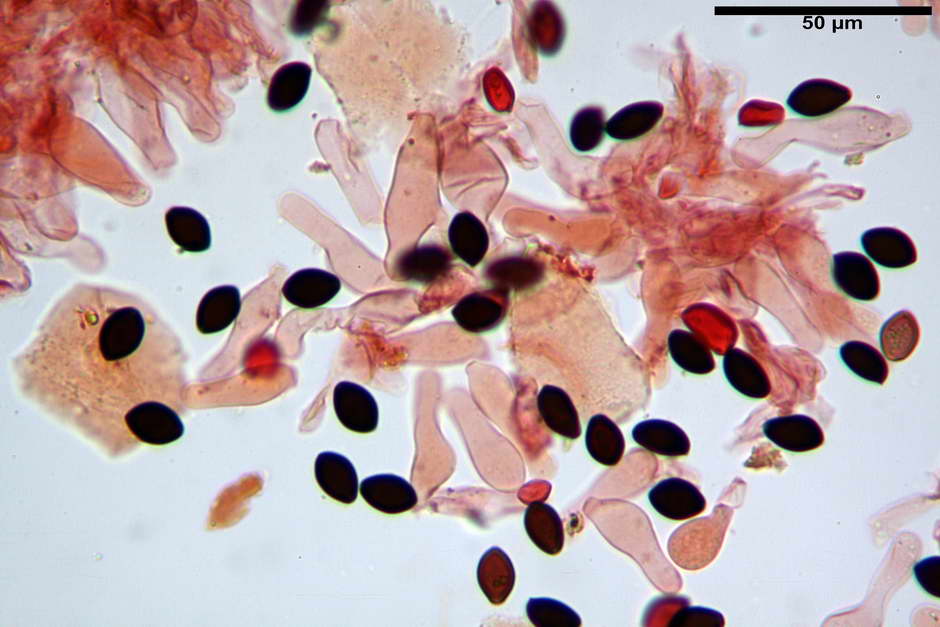
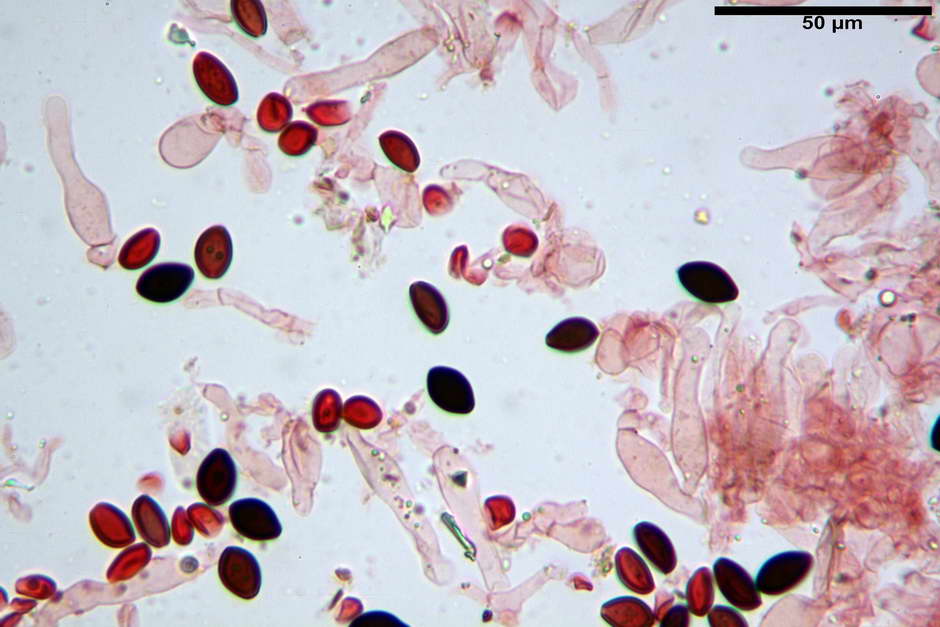
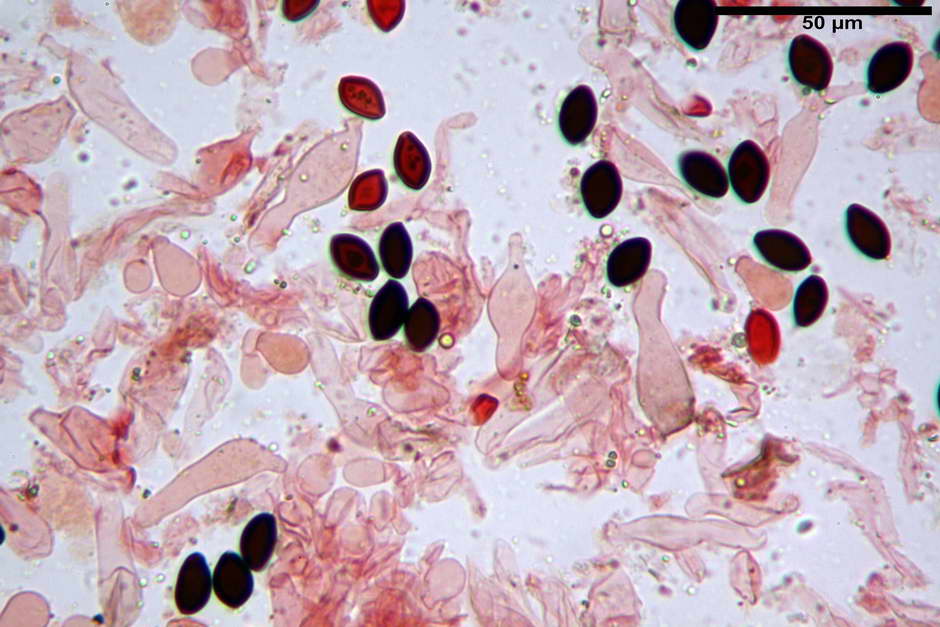
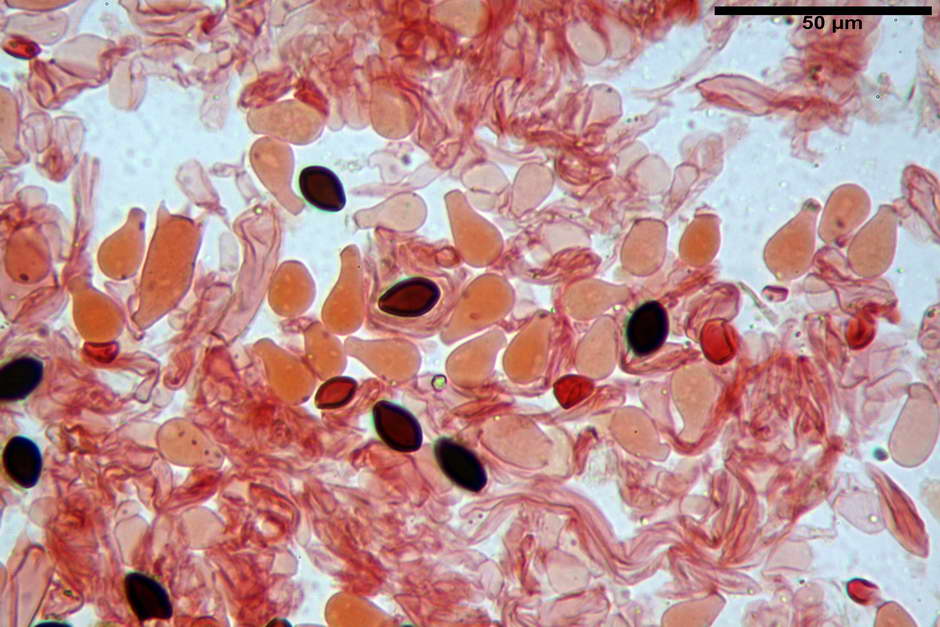
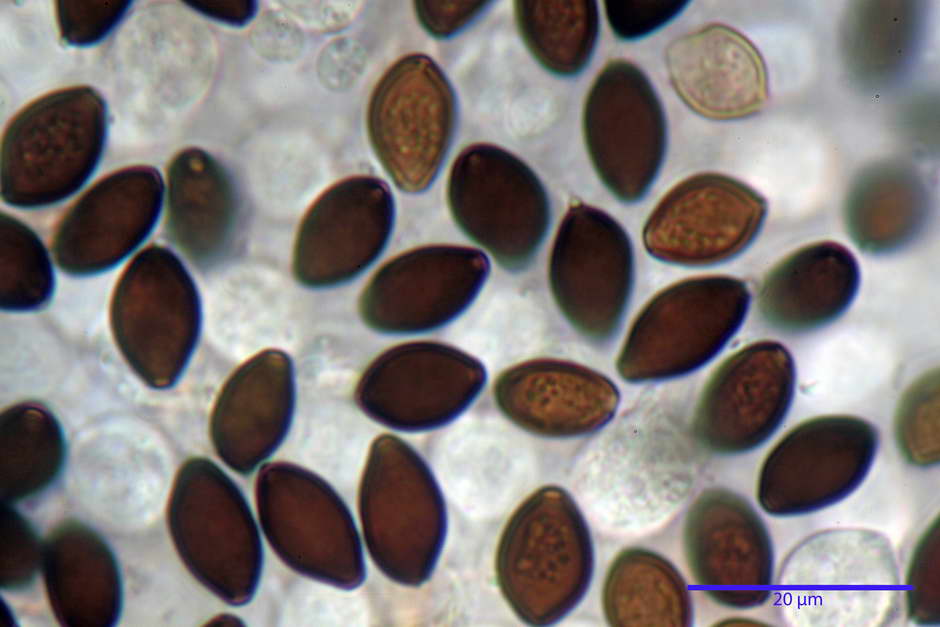
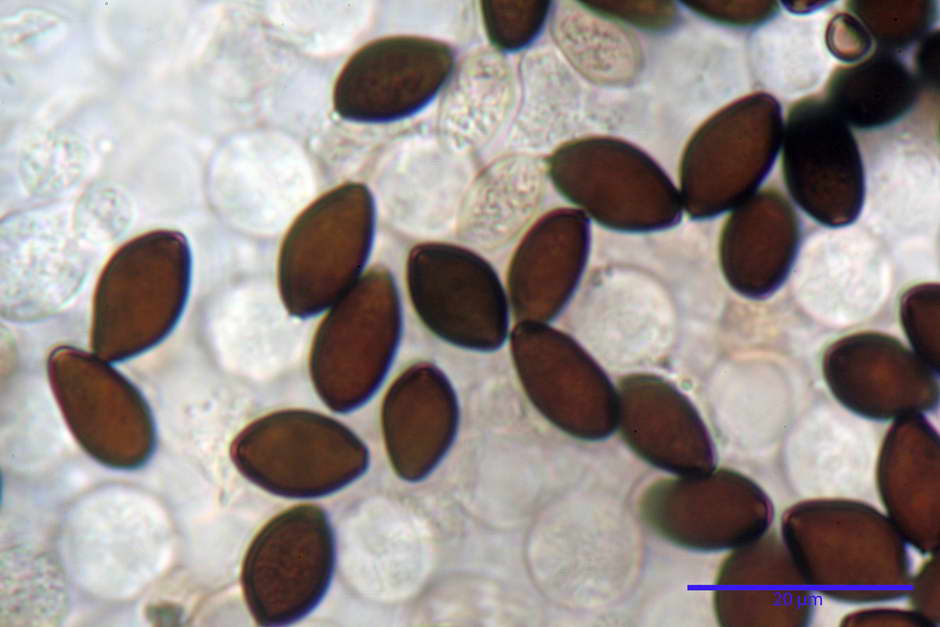
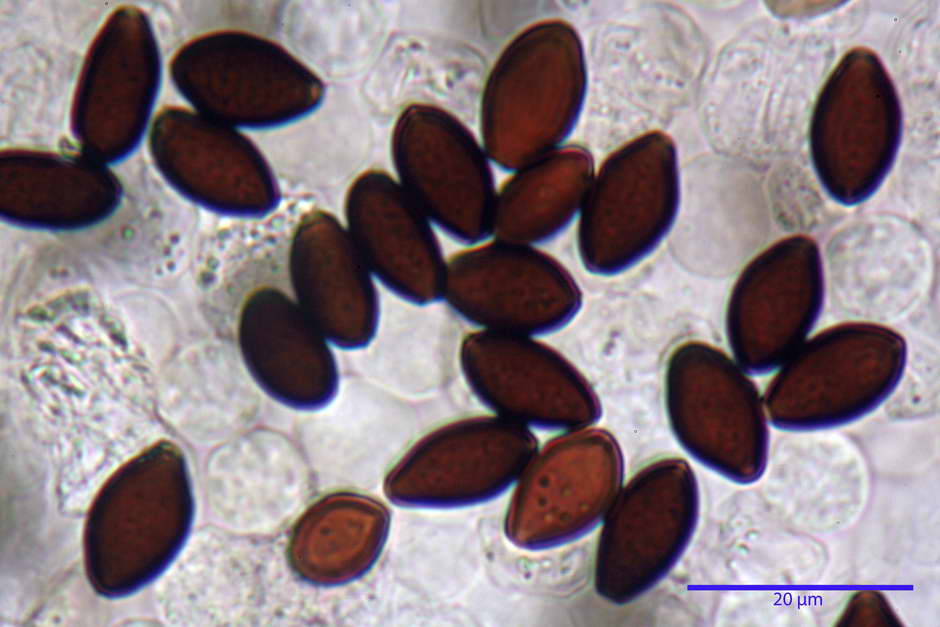
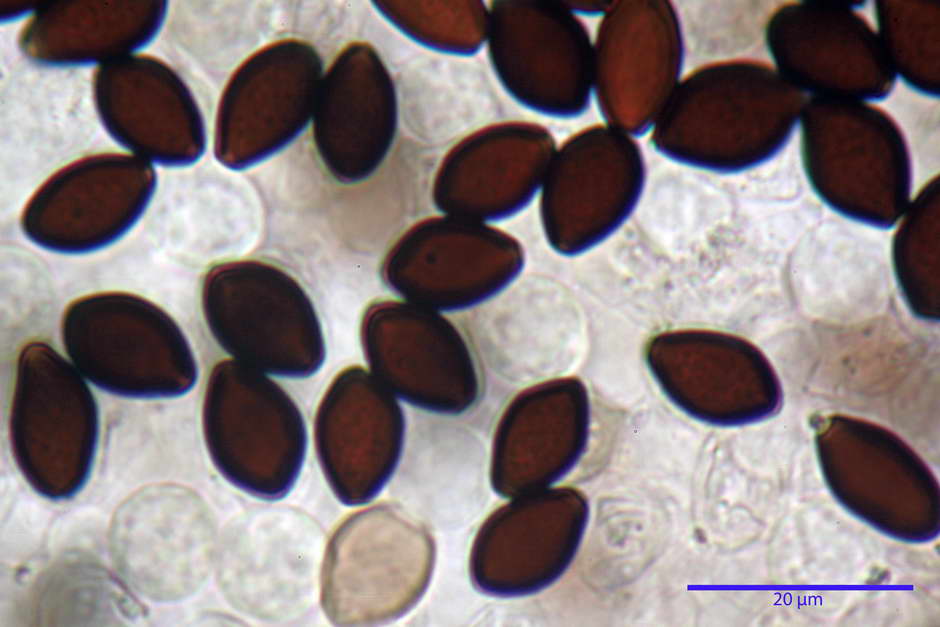
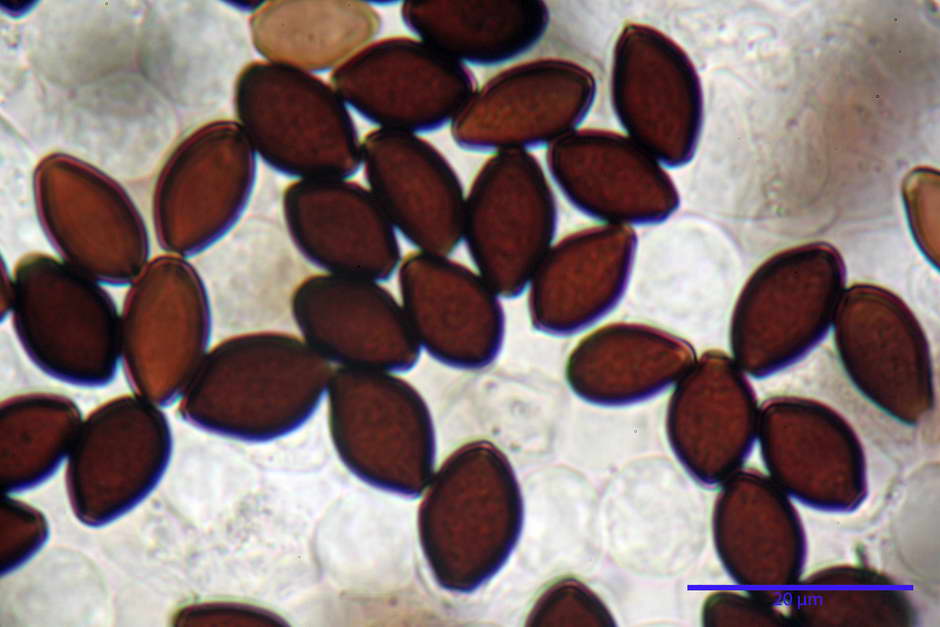
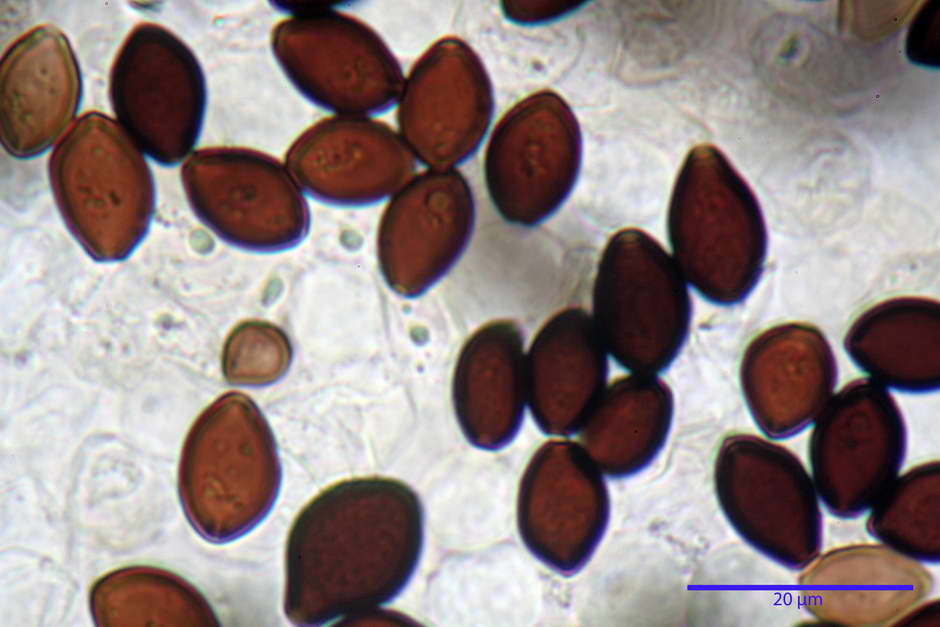
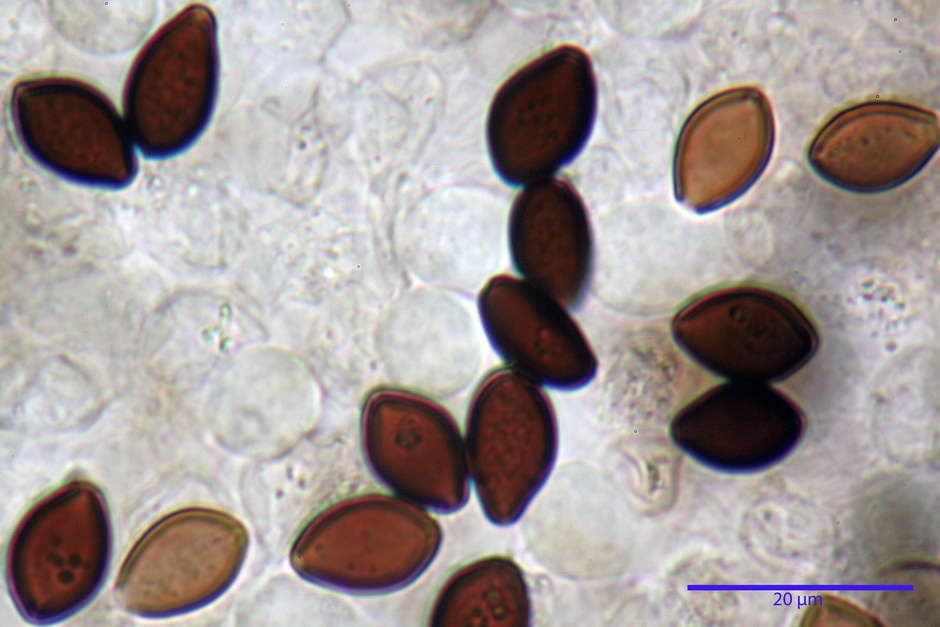
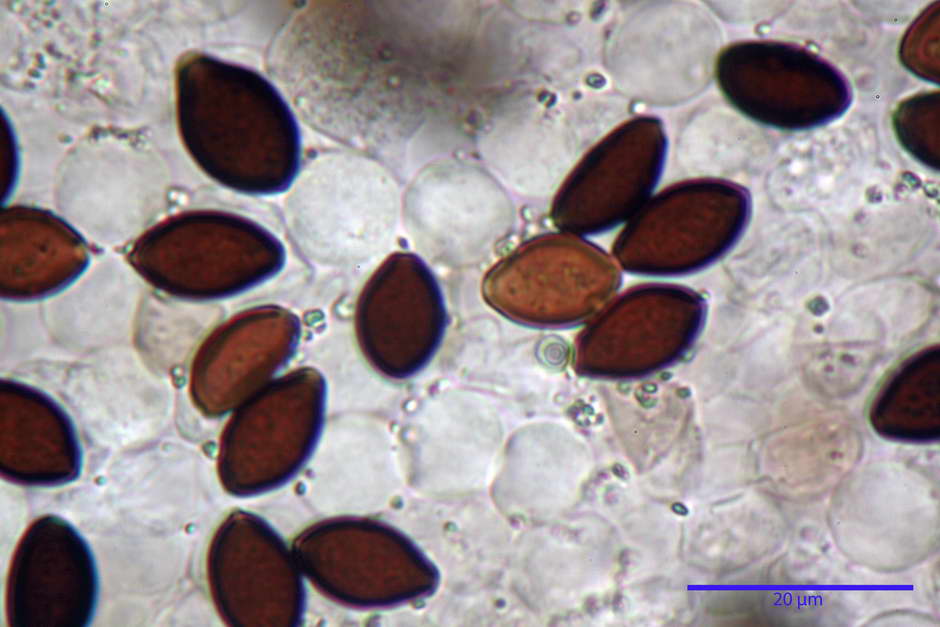
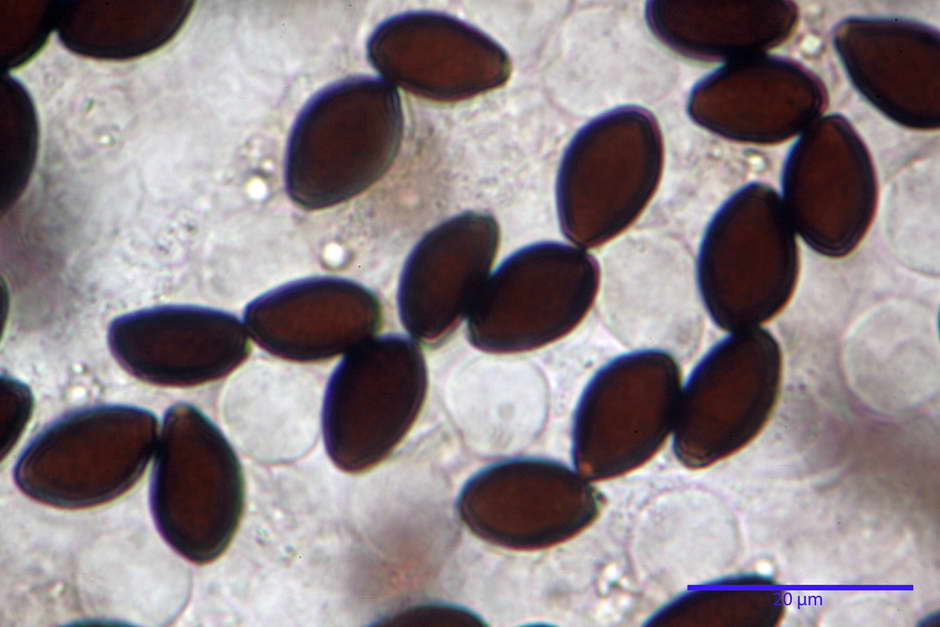
Spore, misure in proiezione frontale (11,13) 12,01-14,36 (15,01) x (7,08) 7,47-8,86 (9,33) µm, in media 13,16 x 8,1µm, Q. = (1,43) 1,49-1,79 (2,01); Q.m = 1,63; Vol. = (329) 372-573 (676); Vol.m = 455 µm³, in proiezione frontale citriformi, più raramente submitriformi.
Misure in proiezione laterale (11,37) 11,67-14,21 (14,77) x (6,21) 6,34-7,61 (7,88) µm, in media 12,81 x 6,89 µm, Q. = (1,67) 1,73- 1,98 (2,13)); Q.m = 1,86; Vol. = (232) 250- 411 (479,8); Vol.m = 320 µm³; da ellissoidi a subamigdaliformi. Lisce, marrone-rossastro in H2O, parete larga fino a 1,3 µm, poro germinativo da centrale a eccentrico in proiezione laterale, largo fino a 2,0 µm.
Basidi (24,3) 25,0-27,0 (28,4) x (10,7) 11,0-11,0 (13,4) µm, Q.m = 2,23; Vol.m = 1903 µm³; da cilindrici a subclavati, tozzi, in maggioranza tetrasporici, raramente bisporici.
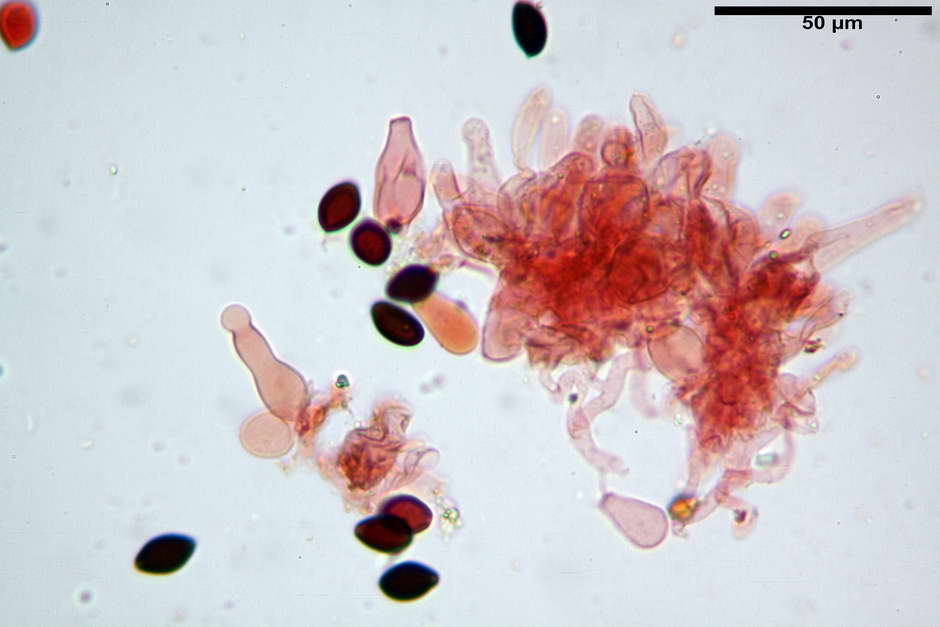
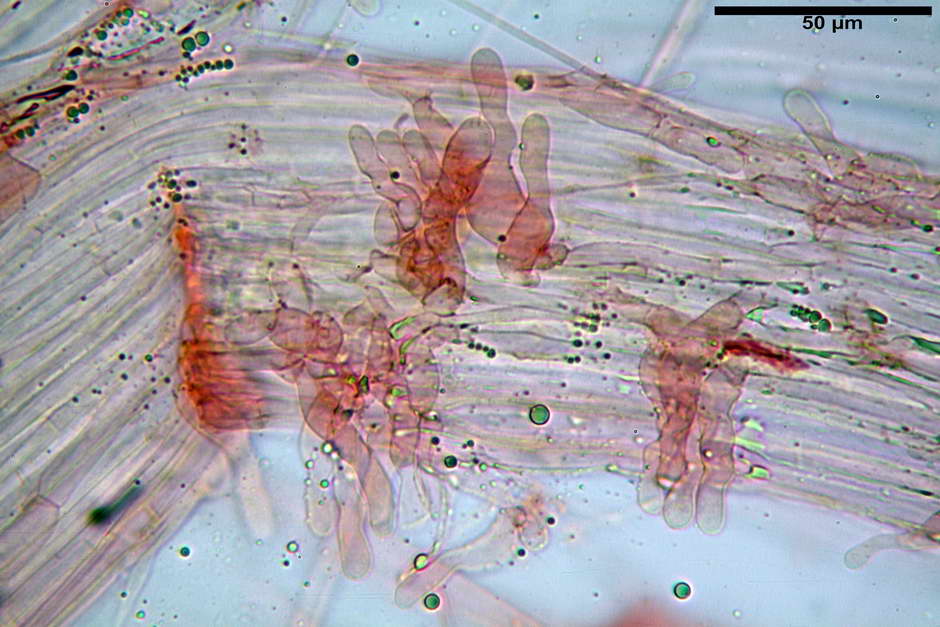
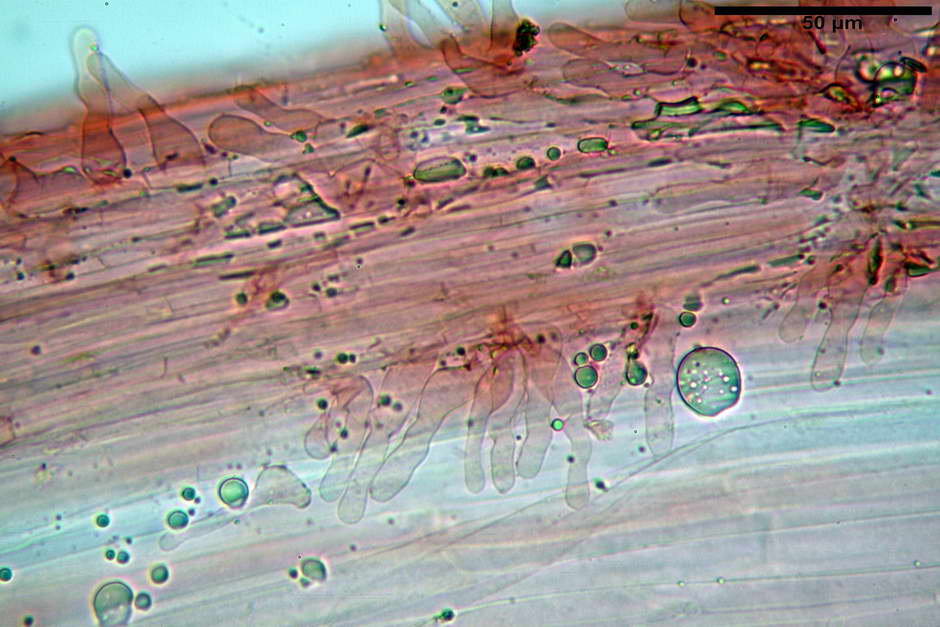
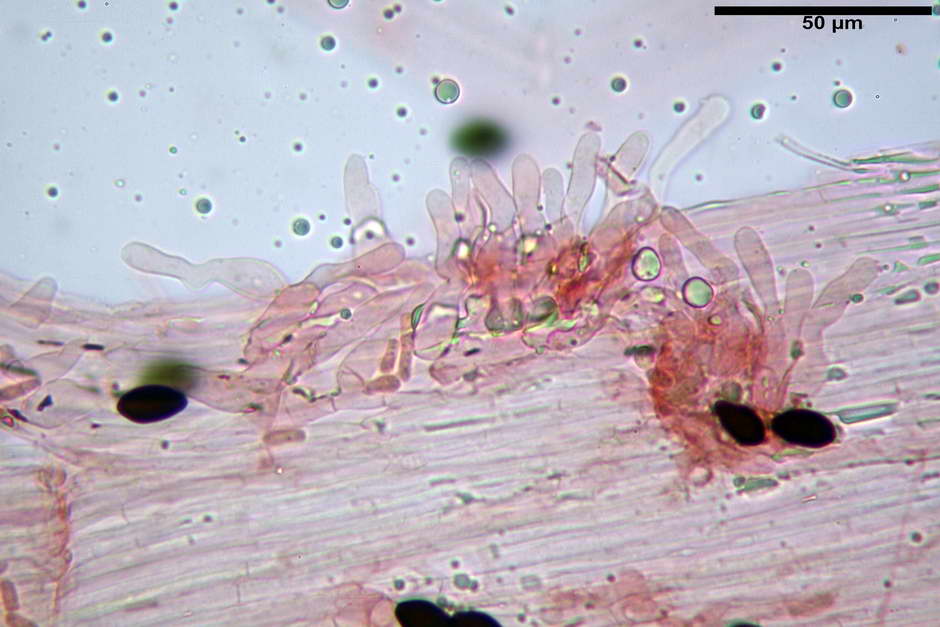
Cheilocistidi (26,3) 28,3-39,0 (42,1) x (7,6) 8,1-11,8 (14,4) µm, in media 34,1 x 9,9 µm,; Q.m = 3,50; Vol.m = 1809 µm³; da più o meno strettamente utriformi a sublageniformi o subcilindrici flessuosi e con apice leggermente subcapitulato, largo 6,5-8,6 µm, ialini, filo lamellare sterile.
Pleurocistidi non osservati.
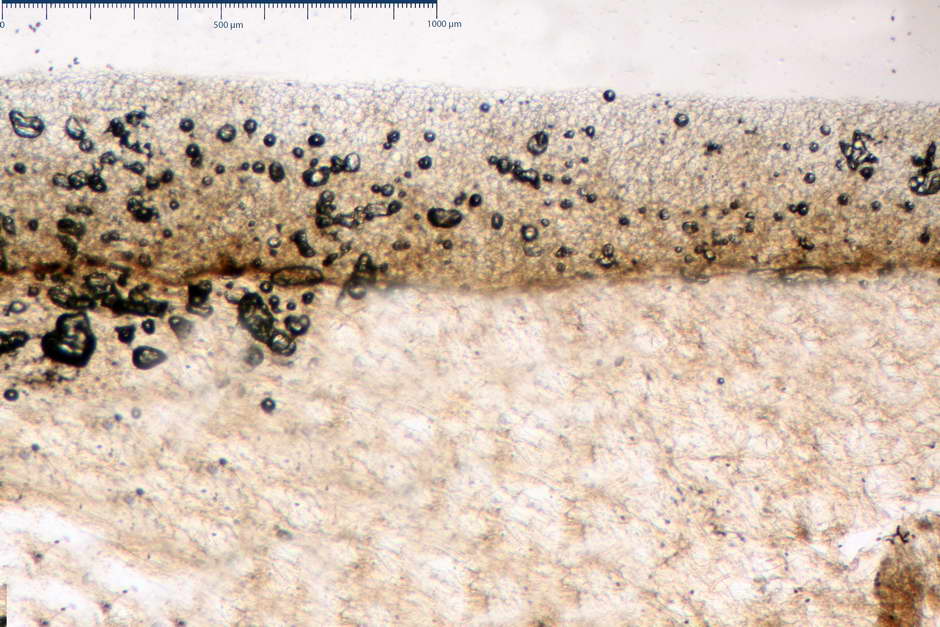
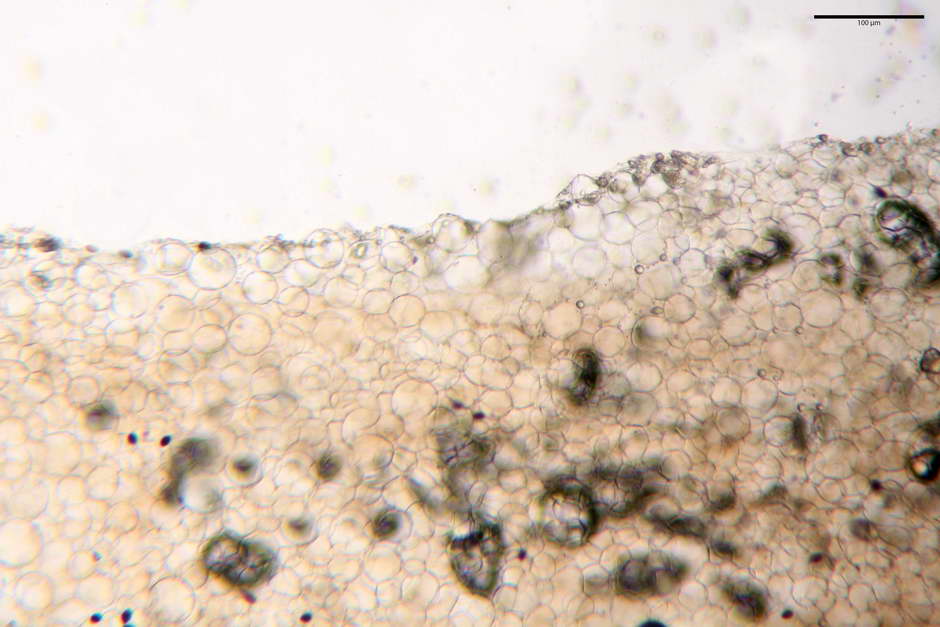
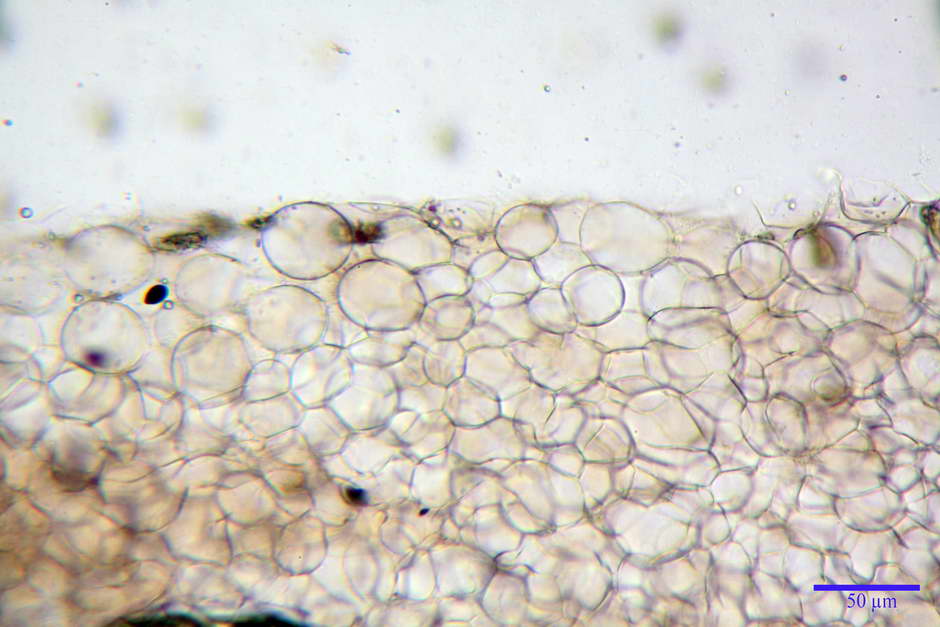
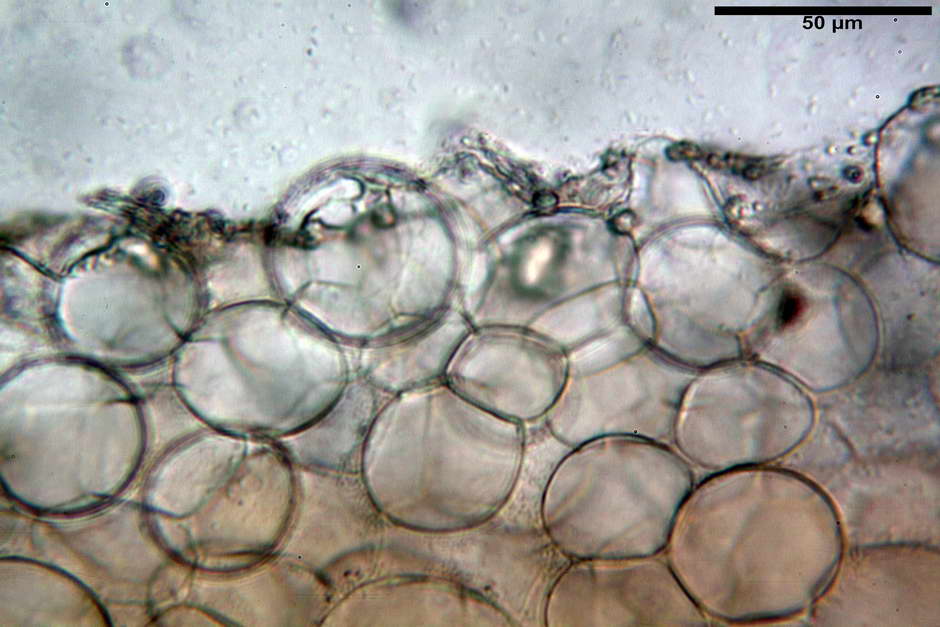
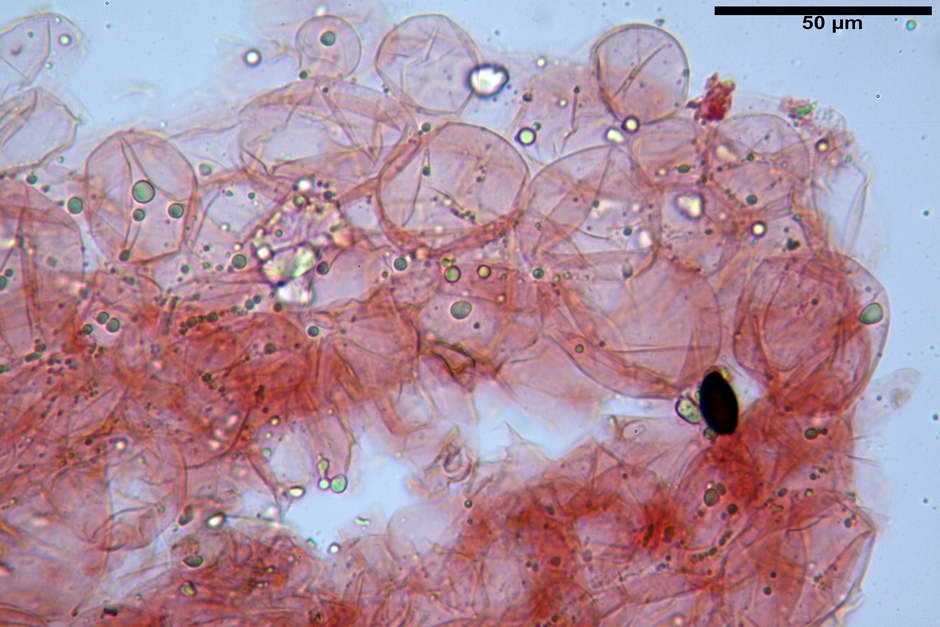
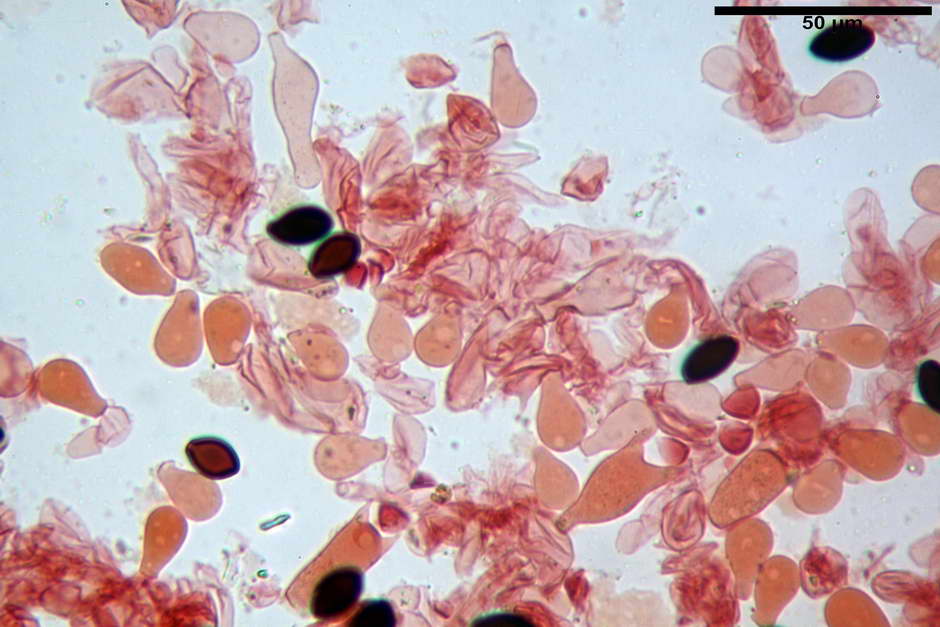
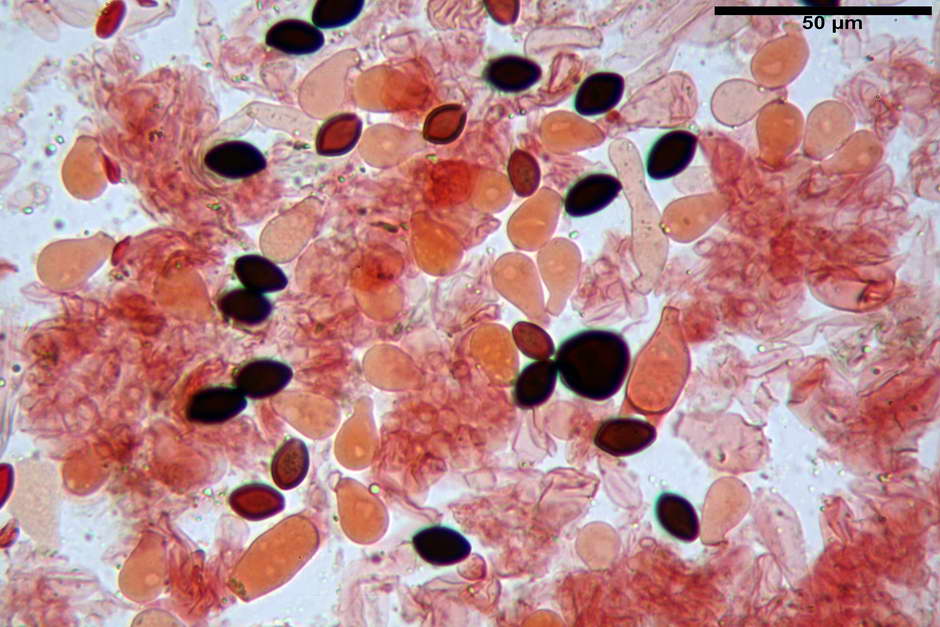
Pileipellis di tipo imeniderma, formata da cellule di tipologia largamente da subglobulosa a clavata, misuranti (25,5) 28,0-44,0 (49,7) x (15,1) 19,0-27,0 (31,7) µm, Vol.m = 11374 µm³. Pileocistidi non osservati.
Stipitipellis formata da ife parallele, cilindriche, ialine, misuranti 2,1-6,3 µm.
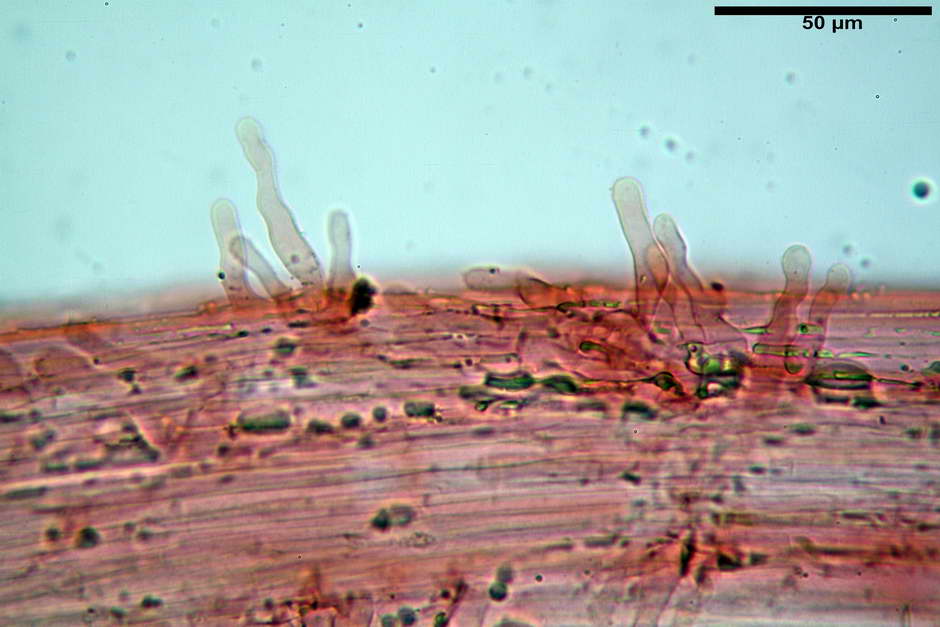
Caulocistidi (23,3) 27,2-43,9 (48,7) x (5,0) 5,6-11,0 (12,7) µm, Vol.m = 1528 µm³, da cilindrici a subcilindrici, con apice di uguale spessore flessuosi, ialini, disposti a fitti mazzetti nella porzione alta dello stipite.
Giunti a fibbia presenti in tutti i tessuti osservati.
Materiali e Metodi
Lo studio è stato compiuto su materiale fresco. I preparati sono stati osservati usando come mezzo di governo H2O; ove necessario, si è adoperato Rosso Congo Ammoniacale 2% per meglio evidenziare le differenti tipologie cellulari.
Le misure microscopiche sono state eseguite con il software di calcolo Mycométre gentilmente fornitoci dal Sig. Georges Fannechère e prelevabile a questo indirizzo http://mycolim.free.fr. Le misure sporali si riferiscono a 100 unità, effettuate in proiezione laterale o, nel caso di spore inequilaterali anche in proiezione frontale, ottenute da sporata scartando spore ancora evidentemente immature, per le rimanenti tipologie cellulari si sono eseguite un minimo di venti misure a tipologia.
Per la terminologia riguardante la tipologia delle caratteristiche macro e microscopiche, si fa riferimento a Else C. Vellinga 1998: (Flora Agaricina Neerlandica 1- Chapter 8; Glossary).
Per quanto riguarda la nomenclatura aggiornata e gli Autori delle specie, nella maggior parte dei casi, si è fatto riferimento all'Index Fungorum http://www.indexfungorum.org/ e http://www.mycobank.org/MycoTaxo.aspx .
Per le osservazioni dei caratteri macroscopici, in alcuni casi, ci siamo valsi di uno stereo microscopio Optech trinoculare e del supporto di foto macro ad alta risoluzione. Le foto macro sono eseguite in habitat e/o, se necessario, in studio, con l'ausilio di una fotocamera Reflex EOS 50D + obiettivo Canon EF 100mm f/2.8 Macro USM. Le foto concernenti la microscopia, sono state eseguite con il corpo macchina della medesima fotocamera, posto sul terzo occhio del trinoculare di un microscopio biologico Optech Biostar B5, supportato da ottiche Plan-APO, illuminazione alogena 12V-50 W a luce riflessa, con regolatore d'intensità. Le collezioni d'erbario sono conservate nell'erbario A.M.B. Gruppo di Muggia e del Carso.
Dati di raccolta e Habitat: N. scheda: 4680. Data di ritrovamento: 09/06/2011. Località: RIO STORTO. Comune: MUGGIA (TS). Coordinate geografiche: 45°35'50.72"N 13°45'48.54"E. Altezza s.l.m.: 17. Habitat: In aiuola fiorita concimata, su sterco equino. Determinatore: Zugna M. Legit: Zugna M.
Data inserimento in erbario: 09/06/2011
Osservazioni
P. cinctulus si caratterizza abbastanza agevolmente per possedere, in genere, una caratteristica fascia più scura che contorna la cuticola a mo' di coccarda, i cheilocistidi di piccola taglia, volentieri strettamente otriformi o lageniformi e subcapitulati, le spore, viste in proiezione laterale, presentano spesso un poro germinativo eccentrico.
Le specie che più facilmente si potrebbero confondere con esso, nell'eventualità che la fascia che caratterizza la specie sia assente (noi abbiamo studiato una raccolta dove questa non era presente ed abbiamo avuto alcune difficoltà per separarlo dalle specie elencate di seguito).
P. fimicola è riconoscibile per le tonalità olivastre della cuticola, le spore più piccole 9-12 x 6-7 µm, tutte con poro germinativo centrale, ed i cheilocistidi di forma differente.
P. olivaceus soprattutto per le spore rugose.
P. atrobalteatus si differenzia per le possedere spore più piccole 8,5-11 x 6-7,5 µm, e tonalità pileiche olivastre.
I rimanenti appartenenti al genere Panaeolus (fatte salve eventuali sinonimie), si possono separare abbastanza agevolmente.
Bibliografia
Bon M. (1992) - Clé monographique des espèces galero-naucorioides. Doc. Mycol., XXI(84): 1-84.
Bon M. & Cortequisse R. 2003. Clé de Détermination du genre Panaeolus (Fr.) Quélet. Documents Mycologique p. 75-93.
Breitenbach, J. & Kränzlin, F. (1995) - Champignons de Suisse. Tome 4. Edition Mykologia, Lucerne (Suisse).
Cacialli G., Caroti V. & Doveri F., 1995. Funghi fimicoli e rari o interessanti del litorale toscano. Schede di Micologia 1. A.M.B. Fondazione Centro Studi Micologici.
Doveri F., 2004. Funghi fimicoli Italici. A.M.B. Fondazione Centro Studi Micologici.
Gerhardt, E. (1996) - Taxonomische Revision der Gattungen Panaeolus und Panaeolina (Fungi, Agaricales, Coprìnaceae). E. Schweizerbart'sche Verlagsbuchhandiung. Stuttgart.
Index Fungorum: http://www.indexfungorum.org/Names/Names.asp
Ola'h, G.M. (1970) - Le genre Panaeolus. Essai taxinornique etphysiologique. Laboratoire de Cryptogamie du Museum National d'Histoire Naturelle. Paris.
Watling R. - 1982: British fungus flora, Agarics and Boleti. 3. Bolbitìaceae: Agrocybe, Bolbitius & Conocybe. Royal Botarne Garden. Edinburgh.
WATLING R. & BIGELOW H., 1983: Observations on the Bolbitiaceae - 22, in Mycotaxon XVII: 378-389
Watling, R. & Gregory, N.M. (1987) - British Fungus Flora. 5. Strophariaceae & Coprinaceae p.p. Hypholoma, Melanotus, Psilocybe, Stropharia, Lacrymaria & Panaeolus. Royal Botanic Garden, Edinburgh (United Kingdom).








 Questa discussione è bloccata
Questa discussione è bloccata