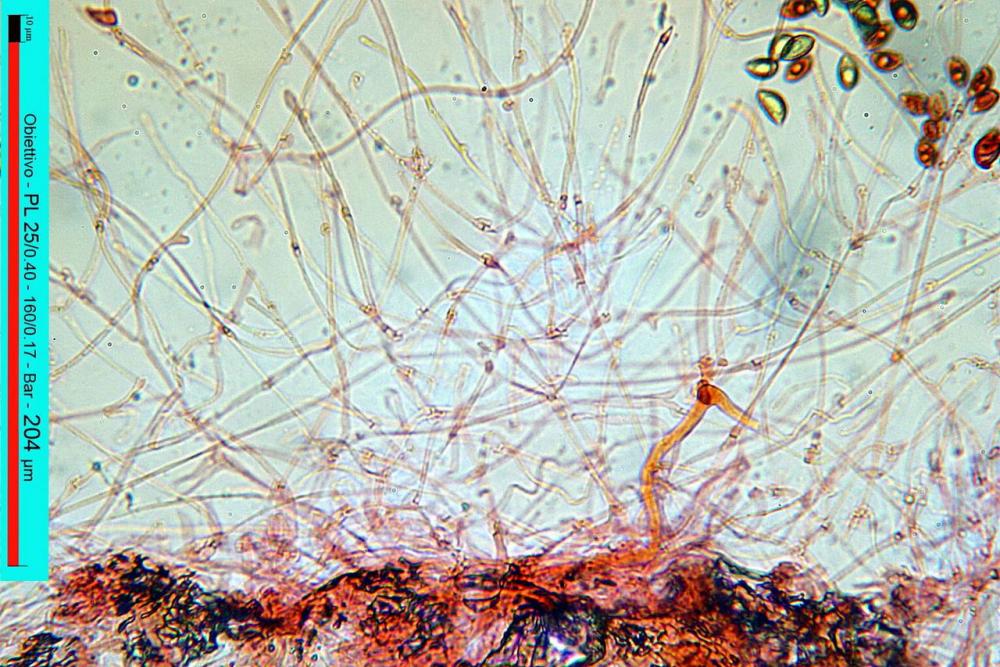
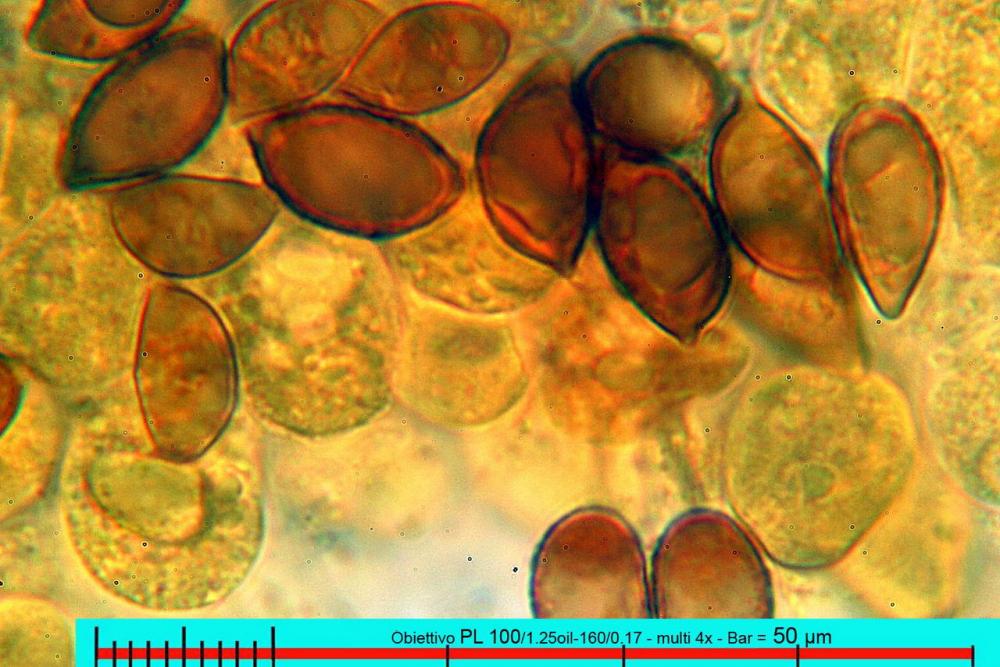
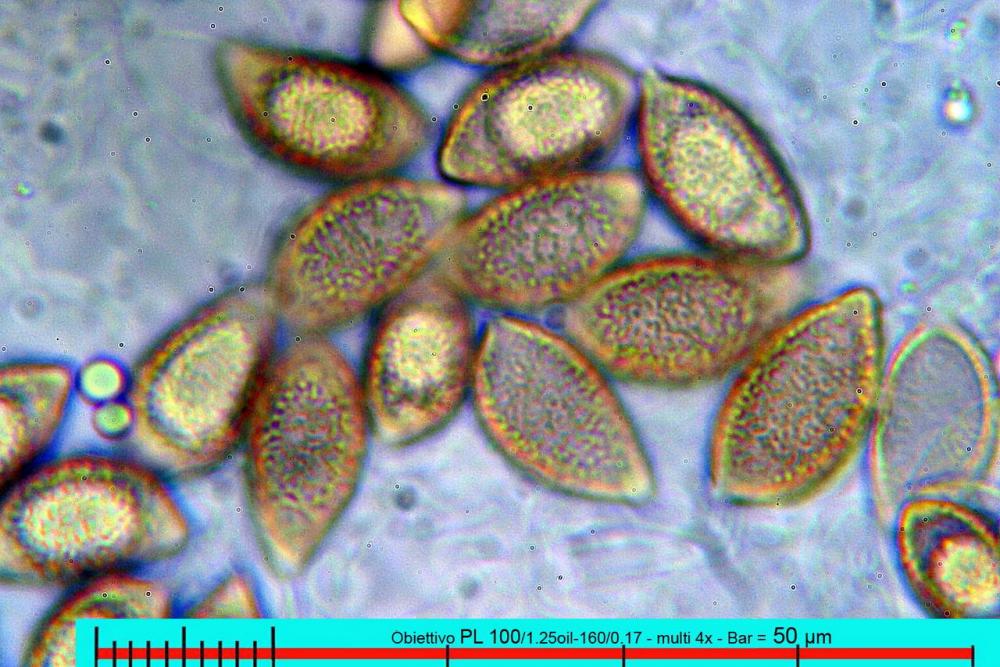
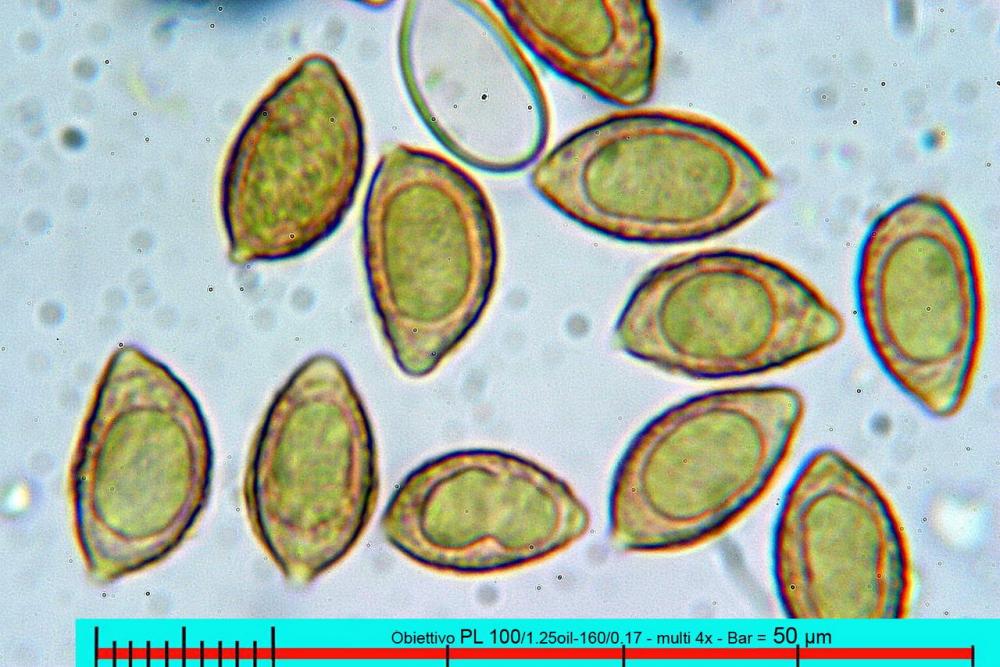
Il biotopo dei Laghetti delle Noghere si estende per circa 12 ettari e ricade nel Comune di Muggia.
Comprende sette laghetti alimentati in parte dalla tracimazione di corsi d'acqua vicini in parte da acque sotterranee ed in parte da apporti meteorici. Lo loro origine è artificiale e deriva dagli scavi per un'industria di laterizi.
Le zone circostanti i laghetti sono ricche in biodiversità.
Le sponde sono ricoperte, in maggior parte, dalla cannuccia d’acqua (Phragmite australis), mentre gli argini e l’entroterra, spesso sottoposti ad inondazioni periodiche, da fitti boschetti idrofili.
Essi sono composti, prevalentemente, da dense macchie di salice bianco (Salix alba) miste al pioppo nero (P. nigra) e ontano nero (A. glutinosa) e più raramente da olmo campestre (Ulmus minor).
Lo stato arbustivo, costituito principalmente da sanguinella (Corylus sanguinea), biancospino (Crataegus monogyna), prugnolo (Prunus spinosa), rovo (Rubus ulmifolius) e fusaggine (Euonymus europeus) risulta stabile nel tempo, mentre l’equiseto massimo (Equisetum telmateya), e alcune specie del genere Potamogeton, si sviluppano abbondantissime e velocemente così come, altrettanto velocemente, si degradano per cause naturali.
Nei sentieri adiacenti i laghetti si incontrano alcuni vecchi esemplari di frassino dalle foglie strette (Fraxinus glutinosa) e nelle zone più periferiche, a ridosso del Bosco Vignano, la “roverella” (Quercus virgiliana), il carpino nero (Ostrya carpinifolia) e sporadici castagni (Castanea sativa). Oltre a queste specie del tutto naturali, lungo i sentieri circostanti, sono presenti la robinia (Robinia pseudoacacia) ed il sambuco (Sambucus nigra).
Lista delle specie erborizzate nel biotopo dei Laghetti delle Noghere.
Taxon - A.A. - data raccolta - Habitat.
Alnicola melinoides (Bull.: Fr.) Kuhn.; 07/11/95, In terra tra muschio P.nigra e A. glutinosa.
Artomyces pyxidatus (Pers. ex Fr.) Julich; 03/11/05, su legno morto di latifoglia.
Bisporella sulfurina (Quél.) Carpenter; 20/11/94, ceppaia marcia di latifoglia.
Clavulina cristata (Holmsk.) Schroet; 03/11/05, ai bordi di u sentiero argilloso sotto P.nigra.
Clavulinopsis laeticolor (Berk. & Curt) Petersen; 26/11/04, boschetto misto di latifoglia in terra.
Clitocybe phyllophila (Fr.) Quél.; 03/11/05, su terra nuda nelle vicinanze di P.nigra.
Conocybe ochrostriata Hauskn.; 13/04/04, in boschetto di latifoglia su terra nuda.
Coprinellus ellisii (P.D. Orton) Redhead, Vilgalys & Moncalvo; 13/04/09, tronco di A. glutinosa morto a terra.
Coprinellus disseminatus (Pers.) J.E. Lange; 30/04/1998, su ceppo di Salix alba.
Coprinellus domesticus (Bolton) Vilgalys, Hopple & Jacq. Johnson; 13/04/04, tronco morto a terra.
Crepidotus mollis (Schaeff. ex Fr.) Kummer; 14/01/14, nel sentiero su tronchetto morto di latifoglia.
Crepidotus subsphaerosporus (Lange) Kühn. & Romagn.; 30/11/95, su ramoscelli morti di A. glutinosa.
Diatrypella quercina (Pers. ex Fr.) Cke.; 17/03/04, ramo di latifoglia morto a terra.
Diatrypella verrucaeformis (Ehrh.) Nke.; 08/03/03, ramo secco di latifoglia a terra.
Entoloma costatum (Fr.) Kummer; 05/11/05, sotto P.nigra e A. glutinosa in terra argillosa.
Entoloma pseudoturci Noordel.; 15/04/94, nella terra tra gli arbusti e Phragmite australis.
Flammulina velutipes (Curt. ex Fr.) Sing.; 12/04/94, albero morto in piedi latifoglia.
Hebeloma gigaspermum Gröger & Zschiesch.; 01/11/00, in terreno umido nei pressi di Salix alba.
Hebeloma ochroalbidum Bohus; 03/11/05, sotto P.nigra e A. glutinosa terreno argilloso.
Hebeloma populinum Romagn.; 03/11/05, sotto salice nelle vicinanze di alcuni P.nigra.
Hebeloma sacchariolens Quél.; 01/11/00, In terreno umido nei pressi di Salix alba.
Hygrocybe cinereifolia Cortequisse & Priou; 03/11/05, in prato aperto vicino al lago.
Hymenogaster lycoperdineus Vittad.; 07/12/03, Carpinus orientalis e Quercus pubescens.
Hypoxylon fuscum (Pers. ex Fr.) Fr.; 08/03/03, ramo morto di latifoglia a terra.
Hypoxylon howeianum Peck; 13/03/03, Ramo morto di latifoglia a terra.
Inocybe agardhii (Lund) Orton; 15/04/94, ai lati di sentiero tra detriti e Phragmite australis.
Inocybe cincinnata (Fr.) Quél.; 03/11/05, nei pressi del laghetto P.nigra e A. glutinosa.
Inocybe leucoblema Kühn.; 03/11/05, nei pressi bordo del laghetto sotto P.nigra e Salix alba.
Inocybe rimosa (Bull.) Kumm.; 25/11/94, idem sotto Salix alba e A. glutinosa in riva al lago.
Inocybe terrigena (Fr.) Kühn.; 25/11/94, sotto Salix alba e A. glutinosa in riva al lago.
Lacrymaria lacrymabunda (Bull.) Pat.; 03/11/05, ai bordi del lago in zona prativa.
Lentinus tigrinus (Bull.) Fr.; 16/04/95, Ceppaia di Salix alba.
Micromphale foetidum (Sow. ex Fr.) Sing.; 03/11/05, su tronco morto di A. glutinosa.
Mitrophora semilibera (D.C. ex Fr.) Lév.; 15/04/94, Ai bordi del lago tra Phragmite australis.
Mycena acicula (Schaeff. ex Fr.) Kummer; 26/11/04, al bordo del sentiero terricola.
Mycena galericulata (Scop. ex Fr.) S.F. Gray; 12/04/94, ceppaia marcia di latifoglia.
Octavianina asterosperma (Vittad.) O. Kuntze; 04/12/03, sotto Corylus avellana.
Octospora roxheimii Dennis & Itzerott; 20/11/94, su terreno con tracce di bruciato tra Funaria hygrometrica.
Parasola auricoma (Pat.) Redhead, Vilgalys & Hopple; 14/05/94, cips di latifoglia.
Phellinus punctatus (Fr.) Pilát; 18/04/03, A. glutinosa e Salix alba, tronco morto in piedi.
Phellinus tuberculosus (Baumg) Niemelae; 17/04/09, su pianta morta in piedi di P. spinosa.
Pholiota conissans (Fr.) Mos.; 15/04/94, scarpata di torrente.
Pholiotina aeruginosa (Romagn.) Mos.; 03/11/05, Q. pubescens e O. carpinifolia e alcuni C. sativa a terra e su resti legnosi.
Pholiotina arrhenii (Fr.) Sing.; 03/11/05, su tronchetto radicale interrato.
Pholiotina mairei Kühn.; 14/01/14, nel sentiero ombroso e umido a terra tra il muschio.
Pleurotus cornucopiae (Paul. ex Fr.); 04/11/05, su legno morto di latifoglia.
Pleurotus ostreatus (Jacq. ex Fr.); 14/01/14, nel sentiero su tronco morto in piedi di P.nigra.
Pluteus hiatulus Romagn.; 25/04/00, su legno di P.nigra.
Pluteus romellii (Britzelm.) Sacc.; 14/05/94, cips di latifoglia.
Propolis versicolor (Fr.) Fr.; 03/11/05, su legno morto di latifoglia.
Puccinia recondita Dietel & Holw.; 09/06/08, su steli e pagine fogliari inferiori di Clematis vitalba.
Scutellinia scutellata (L. ex St.Amans) Lambotte; 26/04/98, Ceppaia marcia di latifoglia.
Stereum hirsutum (Wild.) S.F.Gray; 03/11/05, su tronco morto di A. glutinosa.
Tarzetta cupularis (L.) Svrcek; 07/11/95, In terra tra muschio sotto P.nigra e A. glutinosa.
Trametes versicolor (L.) Pilát; 17/03/04, tronco morto di P.nigra.
Tubaria conspersa (Pers. ex Fr.) Fayod; 12/04/94, ceppaia marcia di latifoglia.
Verpa digitaliformis Pers.; 13/04/04, su terra nuda ai bordi del lago nei pressi di Salix alba e Fraxinus glutinosa.
Materiali e Metodi
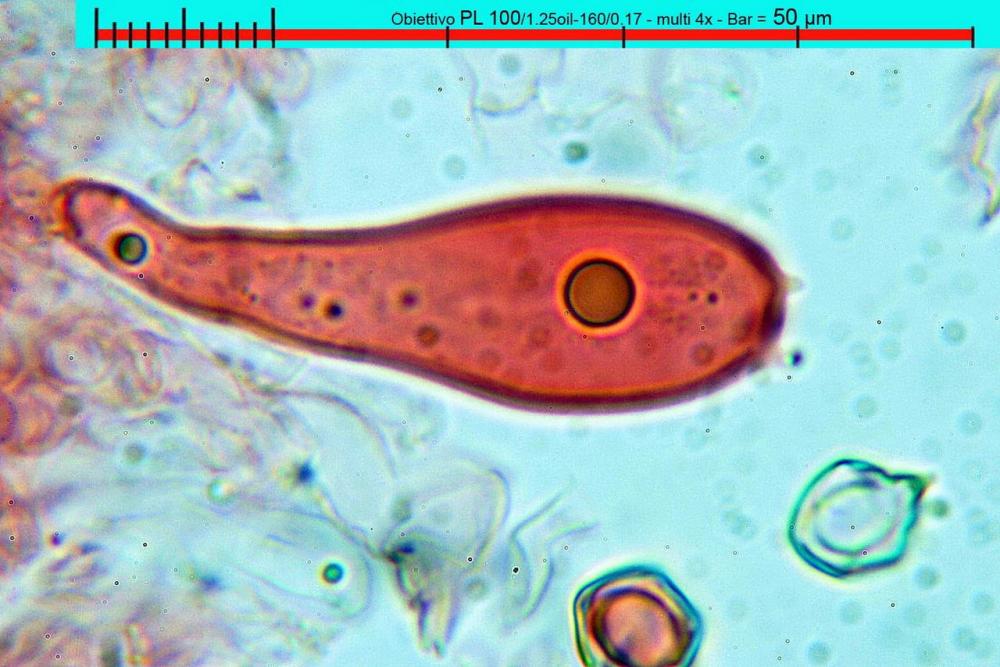
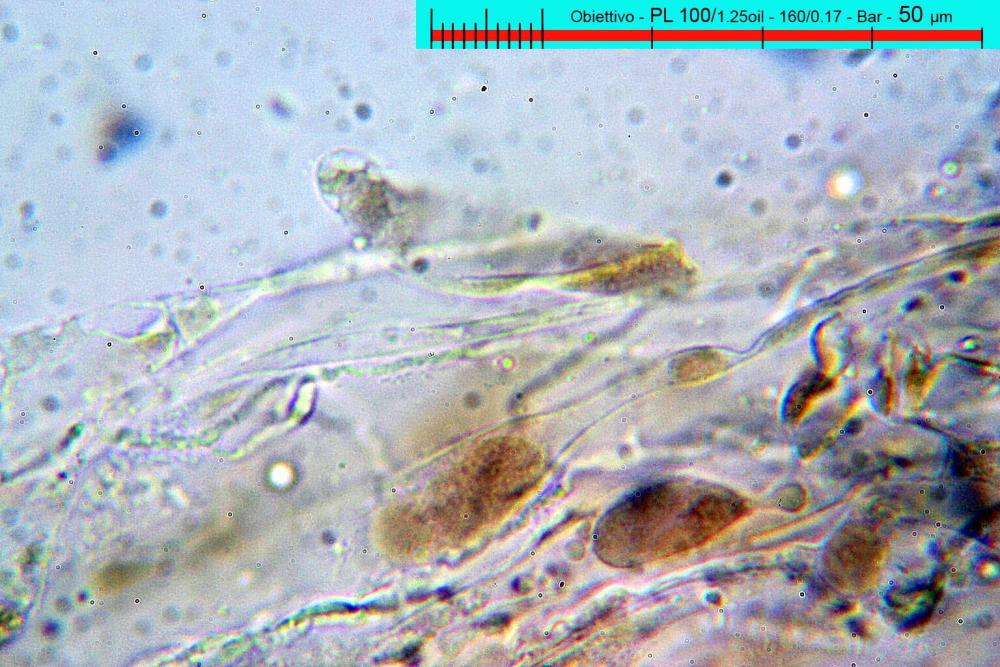
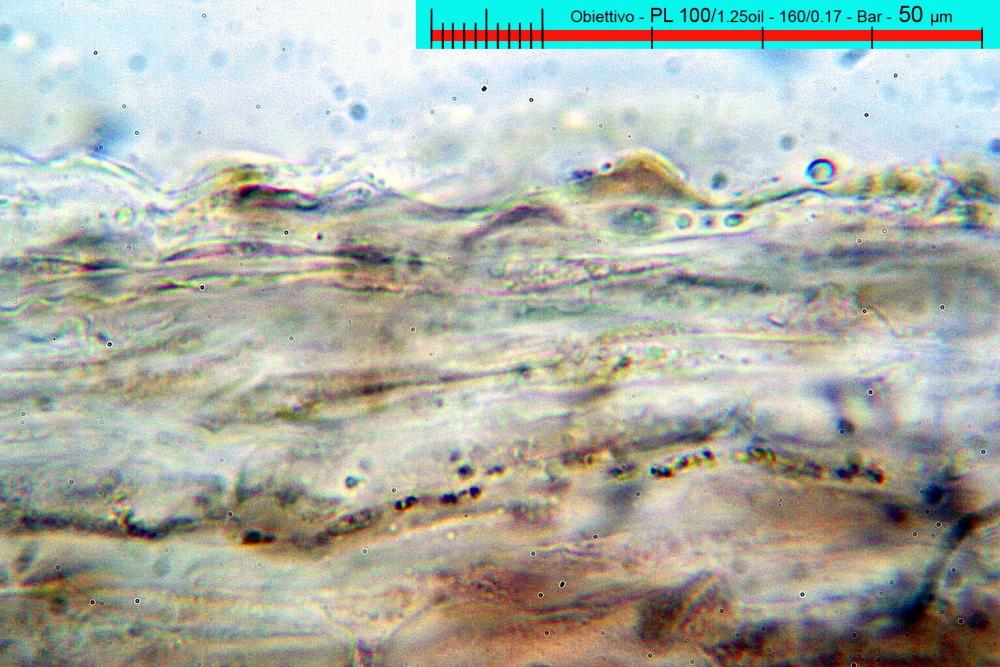
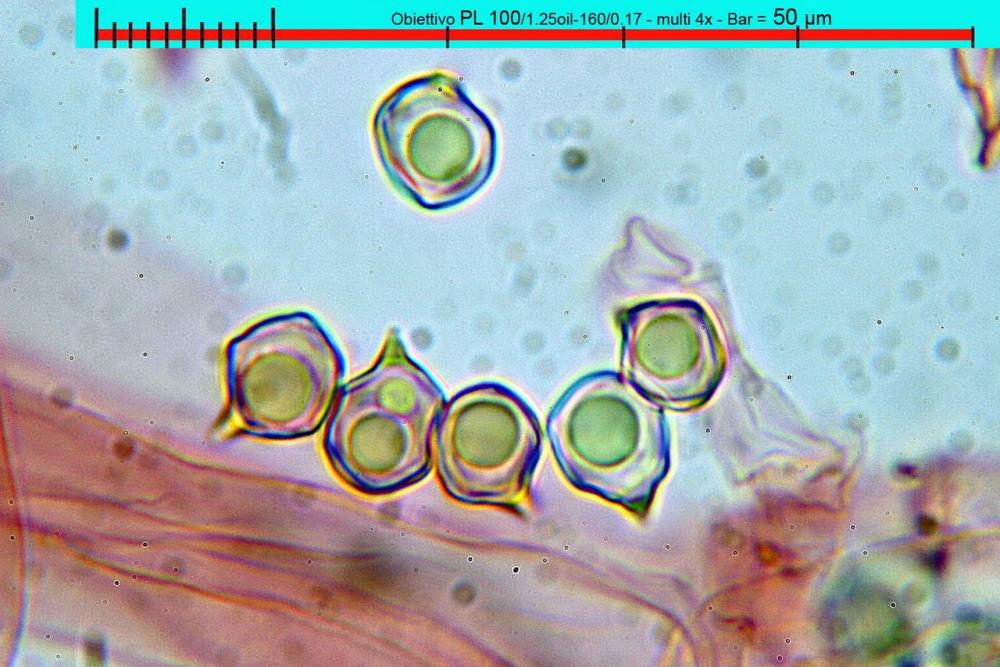
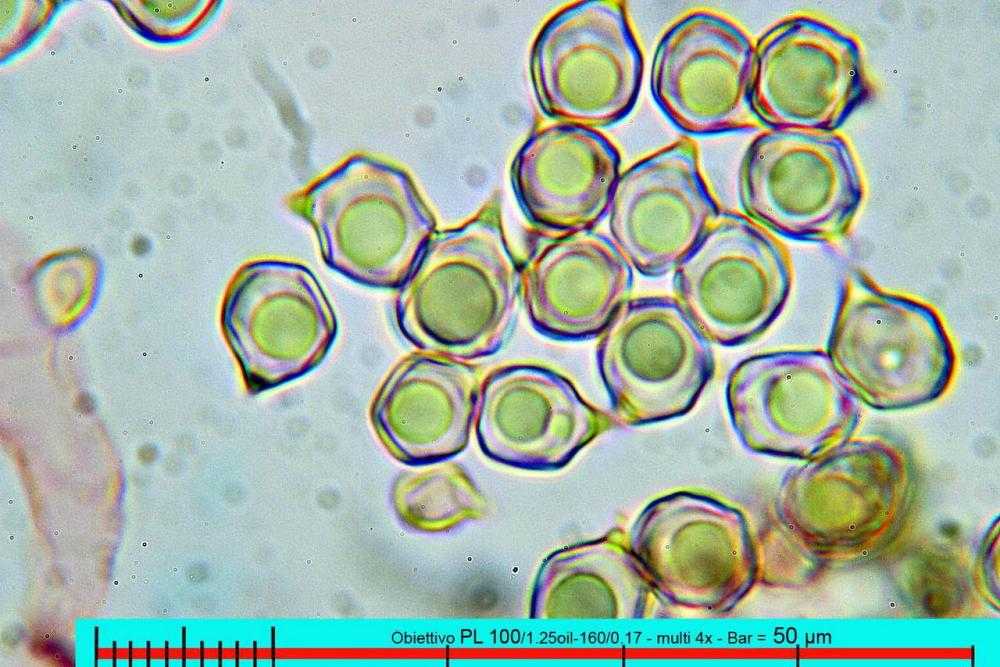
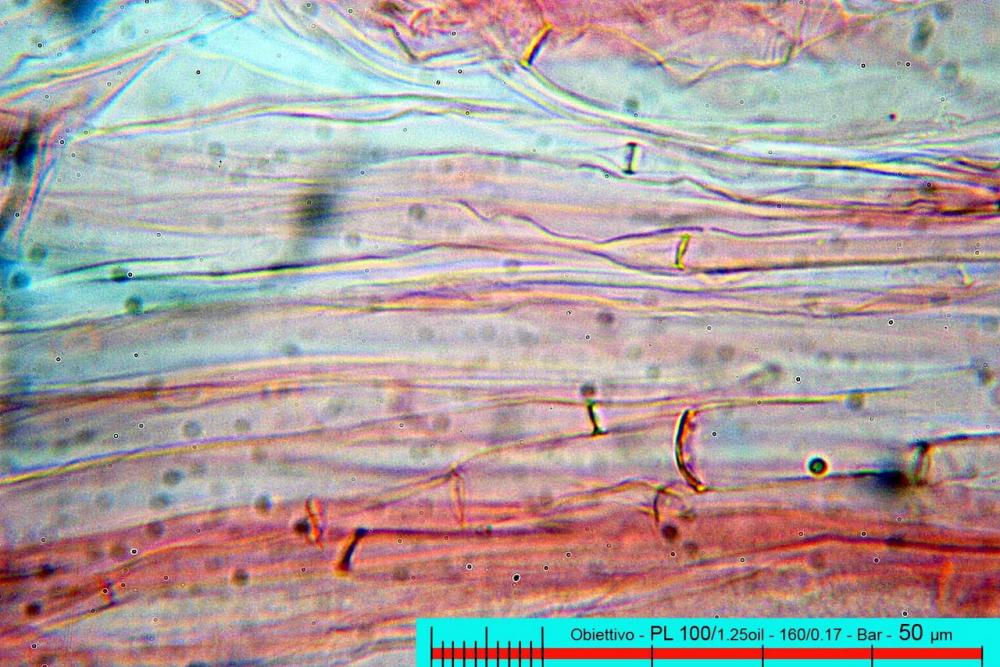
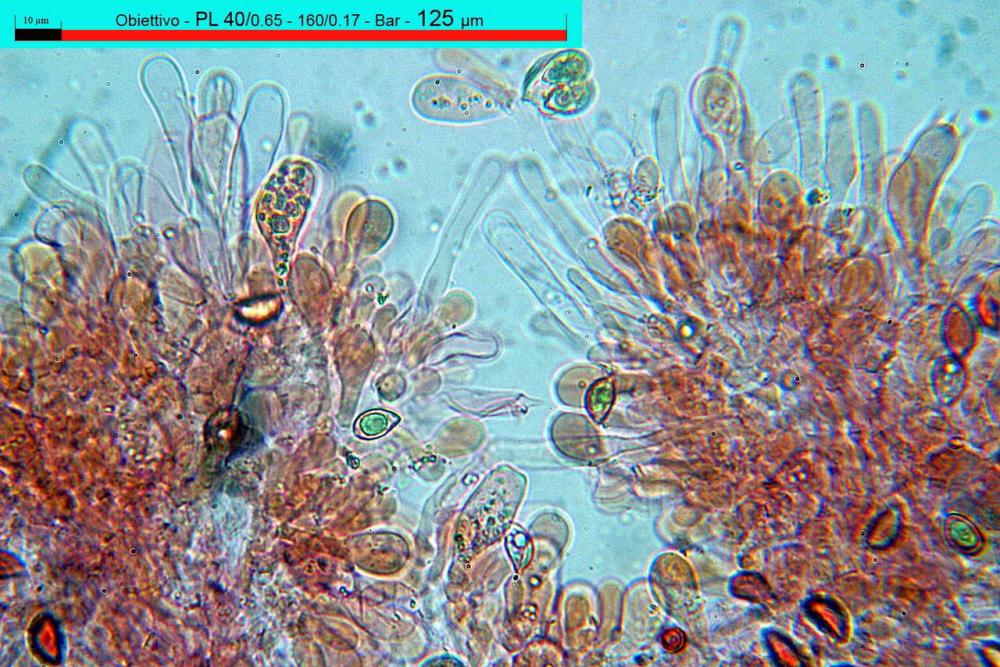
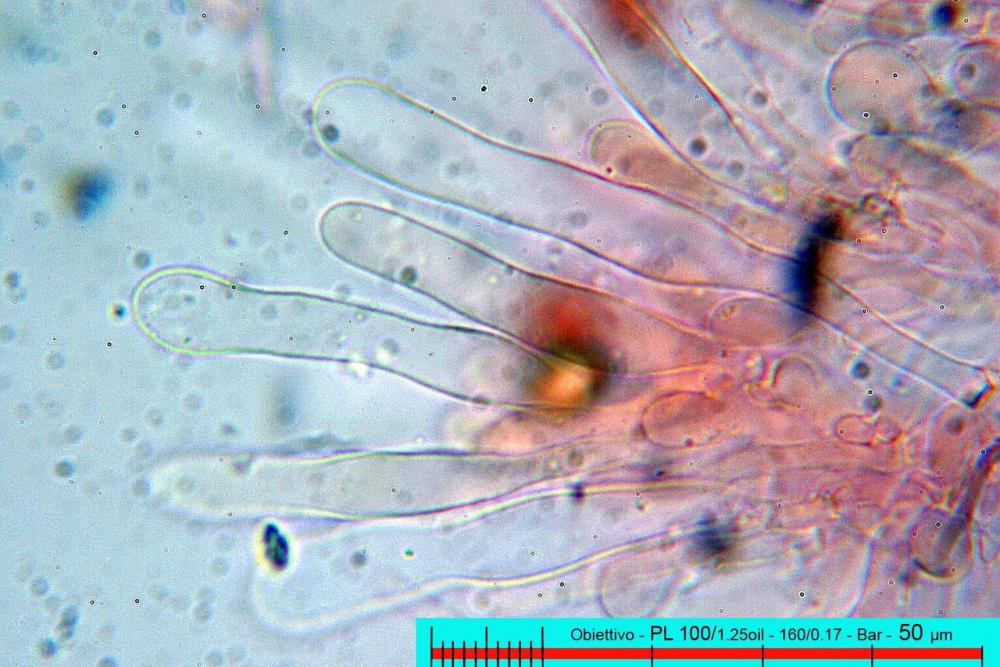
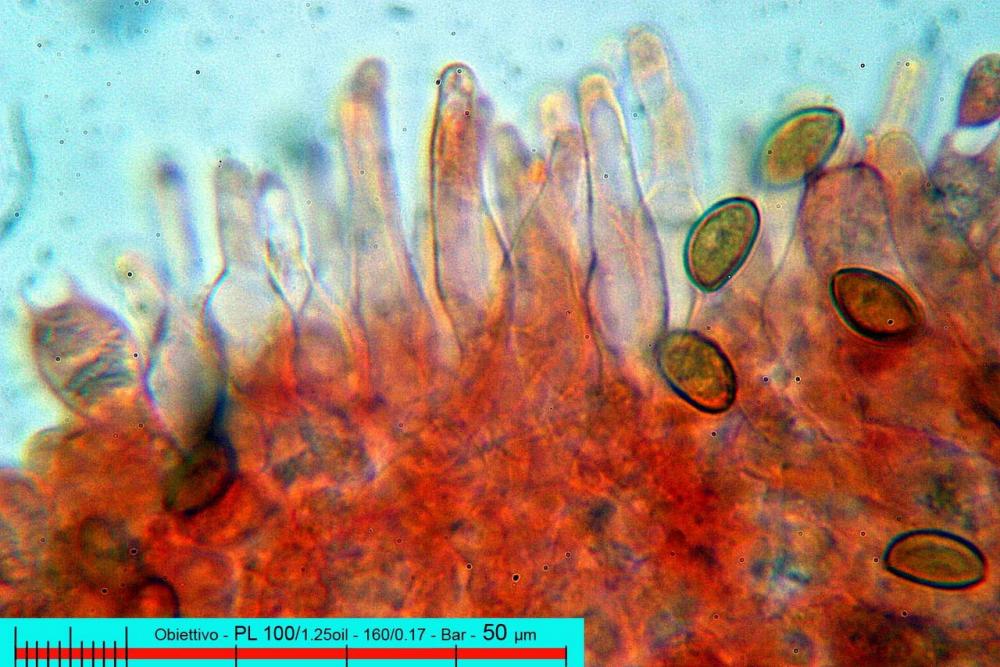
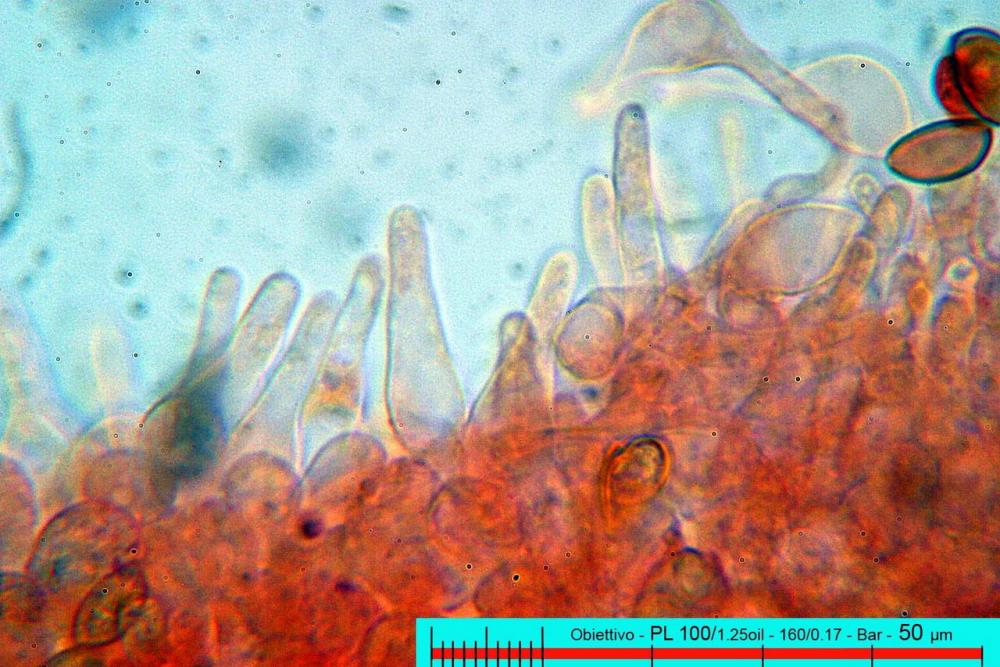
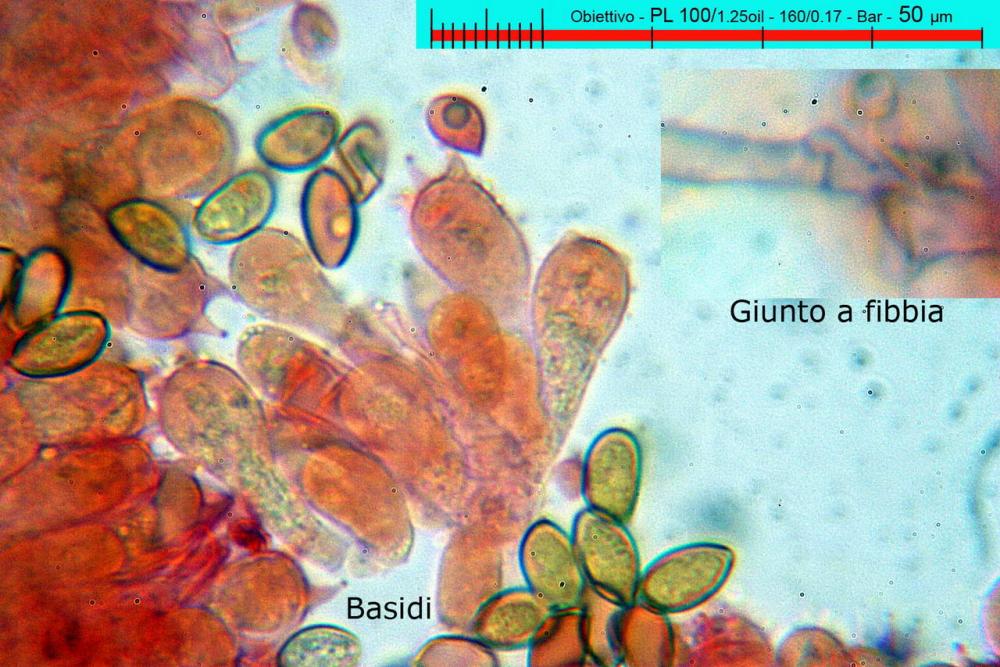
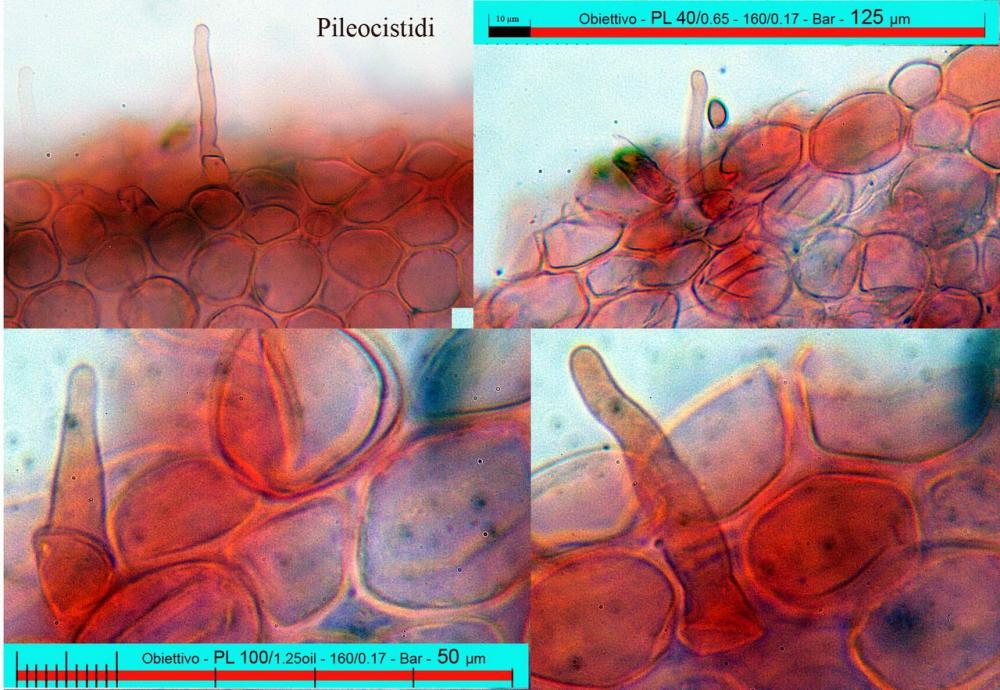
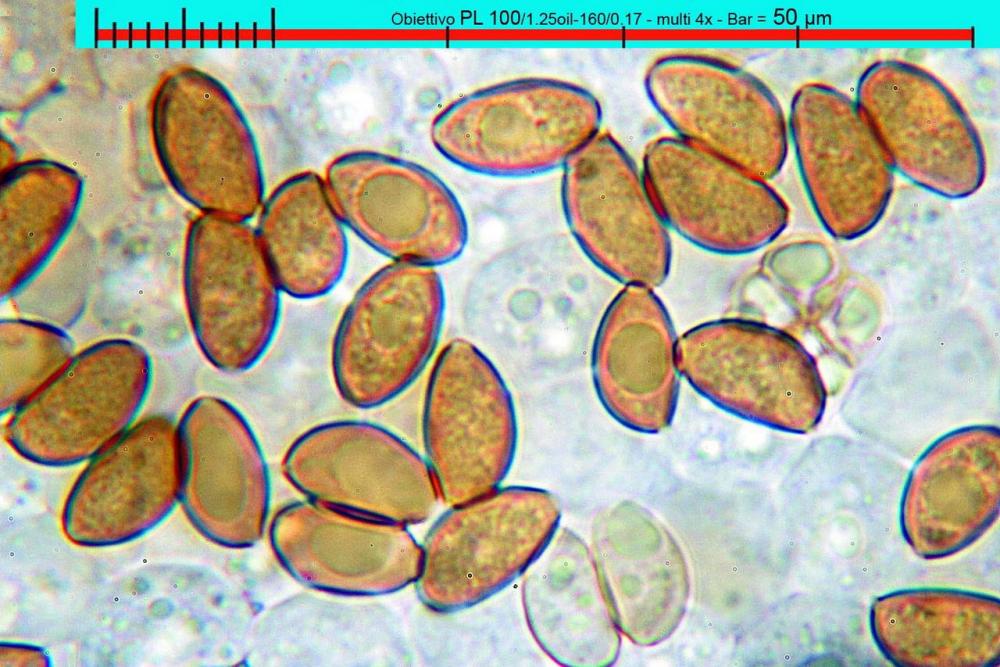
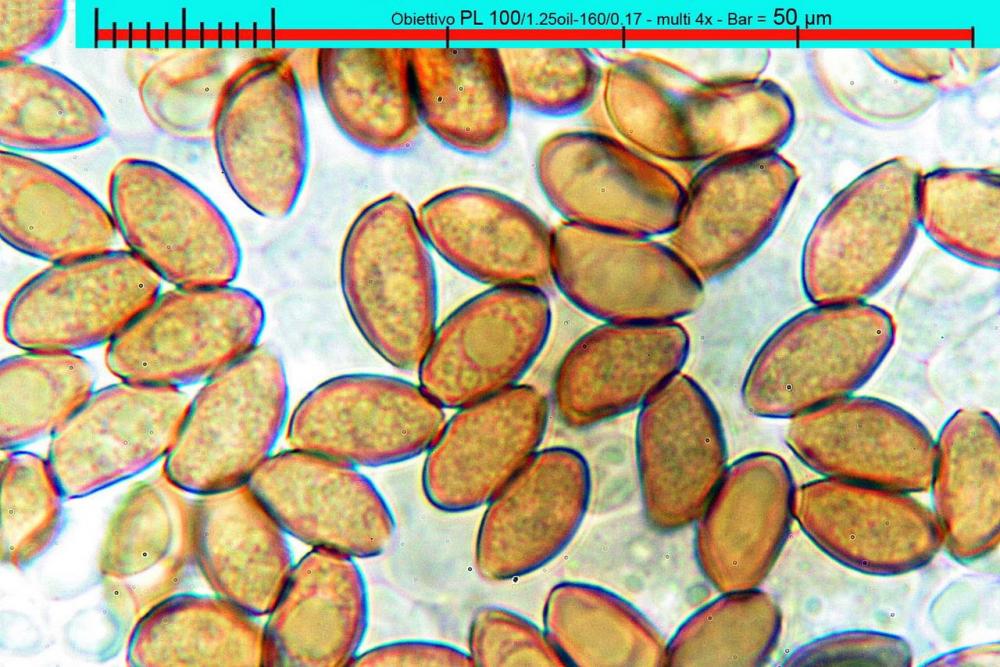
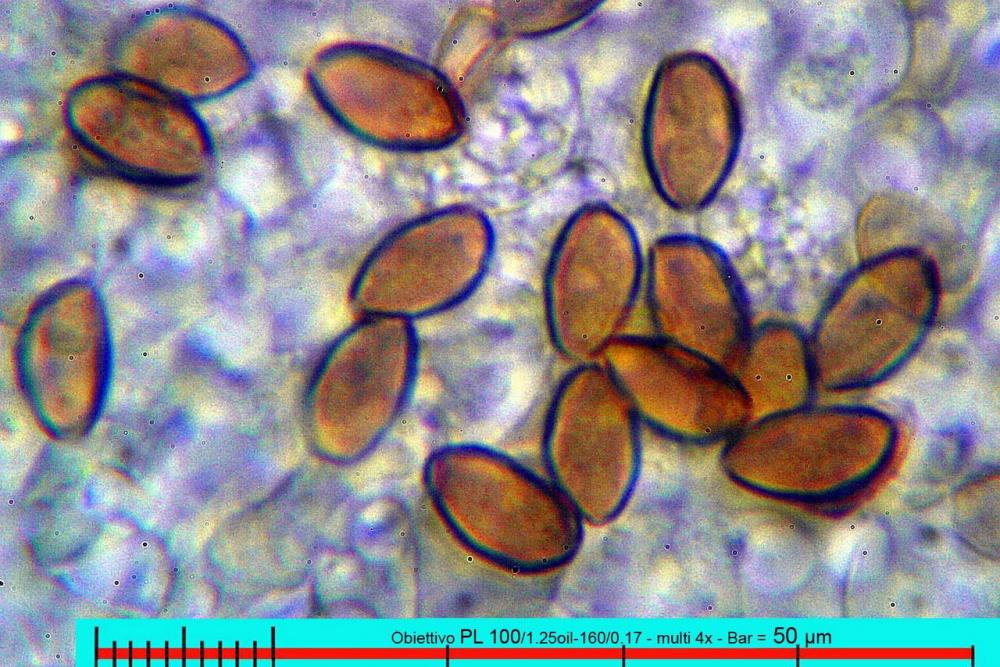
Lo studio microscopico è stato eseguito su materiale fresco. I preparati sono stati montati e osservati in H2O, ove necessario colorati con Rosso Congo Anionico per meglio evidenziare le differenti tipologie cellulari. Il reagente di Melzer è stato utilizzato per l’accertamento della destrinoidia delle spore. Le misure microscopiche sono state eseguite con il software di calcolo Mycométre gentilmente fornitoci dal Sig. Georges Fannechère e prelevabile all’indirizzo http://mycolim.free.fr. Le misure sporali si riferiscono a 100 unità, effettuate in proiezione laterale, ottenute da sporata o prelevate da altre zone non imeniali, scartando dal calcolo le spore ancora evidentemente immature e senza tener conto delle ornamentazioni che, nel caso, si sono misurate a parte. Per i rimanenti elementi cellulari, si sono eseguite un minimo di venti misure per tipologia.
Per la terminologia riguardante la tipologia delle caratteristiche macro e microscopiche, si fa riferimento a Else C. Vellinga 1998: (Flora Agaricina Neerlandica 1- Chapter 8; Glossary).
Per quanto riguarda la nomenclatura aggiornata e gli Autori delle specie, nella maggior parte dei casi, si è fatto riferimento a Index Fungorum http://www.indexfungorum.org/ e http://www.mycobank.org/MycoTaxo.aspx .
Le foto macro sono eseguite in habitat e/o, se necessario, in studio, con l’ausilio di una fotocamera Reflex Canon EOS D60 + obiettivo Canon EF 100mm f/2.8 Macro USM. Le foto concernenti la microscopia, sono state eseguite con l’ausilio della medesima fotocamera, posta sul terzo occhio del trinoculare di un microscopio biologico Optech Biostar B5, supportato da ottiche Plan-APO, illuminazione alogena 12V-50 W a luce riflessa con regolatore d'intensità.
Le collezioni sono depositate presso l'erbario A.M.B. Gruppo di Muggia e del Carso (E.G.M.C.), con i numeri riportati di seguito al binomio nel paragrafo dei dati delle raccolte.
Habitat e Raccolte studiate
Le raccolte sono state effettuate in Località LAGHIETTI DELLE NOGHERE. Comune di MUGGIA (TS). Coordinate geografiche: 45°35'10.27"N 13°48'58.94"E. Altezza s.l.m.: 5.
Entoloma costatum (Fr.) Kummer. N. scheda: 2954. Data di ritrovamento: 05/11/2005. Habitat: in terreno argilloso, sotto Populus nigra e Alnus glutinosa nei pressi delle sponde del laghetto, in terra argillosa. Determinatore: Marino Zugna, Enrico Bizio, legit: M. Zugna, Andrea Aiardi, E. Bizio.
Hebeloma sacchariolens Quél. N. scheda: 3036. Data di ritrovamento: 03/11/2005. Habitat: nei pressi del laghetto maggiore, sotto Populus nigra e Alnus glutinosa, in terreno argilloso. Determinatore: Zugna M. Legit: Zugna M. e altri.
Pholiotina aeruginosa (Romagn.) M.M. Moser (1978). N. scheda: 2955. Data di ritrovamento: 03/11/2005. Habitat: In bosco ombroso e umido di Quercus virgiliana, Carpinus betulus e Ostrya carpinifolia con sporadica presenza di Castanea sativa. Il sottobosco è in gran parte ricoperto da Hedere helix e Ruscus aculeatus. Gli esemplari sono stati ritrovati su terra nuda, appressati a dei rami di quercia, morti a terra. Determinatore: Zugna M,. Bizio E., Bersan Franco. Legit: Zugna M,. Bizio E., Bersan F.
Bibliografia
Bon M., 1992: Clé monographique des espèces galero-nauriocoides. Doc. Myc. Tome xxi, fasc. 84: 76.
Breitenbach J. & F. Kränzlin, 1995: Champignons de Suisse, tome 5. Mykologia, lucerne.
Breitenbach J. & F. Kränzlin, 1995: Champignons de Suisse; tome 4. Lucerne.
Papetti C., G. Consiglio, & G. Simonini, 2001: Atlante fotografico dei funghi d'Italia - vol. 1.
Cetto B., 1987: I funghi dal vero, vol.5, pl.n.1747.
Courtecuisse R. & B. Duhem, 1994: Guide des champignons den France et d’Europe. Delachaux et niestlé.
Gennari A., 2005: 501 funghi. Arezzo.
Hausknecht A., Krisai & Greilhuber I., 1997: Some rare agaricales with brown or darker spores. Fungi non delineati II: 1-32. Libreria Mykoflora-Alassio.
Index Fungorum: http://www.indexfung...names/names.asp
Kühner R. & H. Romagnesi, 1974: Flore analitique des champignons superieurs, Paris.
Malençon G. & Bertault R., 1970: Flore des champignons supérieurs du Maroc. Tome I°. Rabat.
Moser M., 1986: Guida alla determinazione dei funghi, vol. 1, Trento.
Noordeloos M.E., 1992: Fungi Europei n°5. Entoloma: 213-214, 726.
Noordeloos M.E., 1998: Flora Agaricina Neerlandica n° 1: 111.
Noordeloos M.E., 2004: Fungi Europei n° 5a. Entoloma, supplemento: 920-921.
Noordeloos M.E., 2005: Flora Agaricina Neerlandica, vol. 6.
Vesterholt J., 2005: the genus Hebeloma; fungi of Northern Europe, vol. 3.
Laghetti delle Noghere



 Questa discussione è bloccata
Questa discussione è bloccata