MICOCENOSI NEL CASTAGNETO - I° contributo
" funghi tipici di aree bruciate"
Marino Zugna
Località Rio Storto, 7 - 34015 Muggia (TS) E-mail: marinozugna@fastwebnet.it
riassunto
In questo primo contributo vengono presentati alcuni taxa, tipici di aree bruciate, reperiti in un sito che nel 2011 è stato soggetto ad incendi, volontariamente provocati dall’uomo, nell’intento di eliminare virulenti attacchi parassitari. Le descrizioni sono corredate da immagini fotografiche delle caratteristiche macro e micro morfologiche.
abstract
In this first contribution describes some taxa, typical of burned areas, found in 2011 on a site that has been subject to fires, deliberately caused by man, in order to eliminate virulent parasites. The descriptions are accompanied by photographs of macro and micro morphological characteristics.
Key words: Agaricales, Agaricaceae, Coprinellus, Coprinellus bipellis, Psathyrellaceae, Psathyrella, Psathyrella pennata, Strophariaceae, Pholiota, Pholiota highlandensis, Castanea sativa, taxonomy, Italy, micocenosi, termoindotti, termofavoriti, termosopravissuti.
introduzione
Percorrendo la Statale 80 del Gran Sasso, da Teramo verso L’Aquila, ad un certo punto si incontra il paese di Senarica (situato a 630 metri sopra il livello del mare), piccola frazione del Comune di Crognaleto (TE).
Proseguendo il viaggio, ad una decina di minuti di strada, prima di arrivare al paese di Nerito incontriamo il castagneto di Senarica il quale si estende per circa 70 ettari nei pressi di un’altura. Immerso nel verde dei boschi del Parco Nazionale del Gran Sasso e Monti della Laga, il castagneto è considerato un vero e proprio patrimonio boschivo, vista la presenza di numerosi castagni secolari con un diametro di circa 3 metri, il che comprova la sua esistenza già dal lontano 1500.
A salvaguardia di questo ambiente e per debellare il mal dell'inchiostro, una virulenta malattia provocata ai castagni da due funghi patogeni Phytophthora cambivora e P. cinnamomi, è stato adottato il sistema di abbattimento e conseguente indispensabile bruciatura dei castagni morti*.
Gli incendi che ne derivano, benché sembrino un evento tragico, in realtà risultano utili, dal momento che impediscono o per lo meno limitano fortemente ulteriori attività di riproduzione delle spore dei patogeni. In seguito, vi sarà la comparsa di una flora micologica, più o meno specializzata, che si succederà sulle aree bruciate contribuendo, assieme ad altri organismi vegetali pionieri, al processo di ricolonizzazione dell’ambiente danneggiato dal fuoco.
In quanto ai funghi che nascono nelle zone interessate dagli incendi, PACIONI (1987), usa il termine termoindotti, per definire i funghi esclusivi di arre bruciate o per lo meno sottoposta a riscaldamento. Con il termine termofavoriti, si riferisce a funghi, la cui nascita è stimolata dall’azione del fuoco. Con il termine termosopravissuti, si riferisce a funghi che tollerano il bruciato.
Ed è in questo ambiente che, dalla primavera del 2012, il signor Bruno de Ruvo, esperto naturalista e fotografo oltre che carissimo amico, segue costantemente questi ampi ammassi carbonizzati, oramai più o meno sparsi nei pressi dei castagni e ne documenta le micocenosi con fotografie in situ e successiva raccolta di reperti campione, i quali, dopo dovuta essiccazione si premura di inviarmi per lo studio dei caratteri anatomici. Queste raccolte, unitamente ad altre che presenteremo in successivi contributi, ci hanno offerto l’occasione per la stesura di questo lavoro.
*Per saperne di più: www.cmgransasso.it/servizi/tecnici/allegati/Castagneto.doc
Dati di raccolta e habitat
Nella lista delle raccolte useremo le seguenti abbreviazioni:
termoindotti = t-i
termofavoriti = t-f
termosopravissuti = t-s
termoindotti/termofavoriti = ***
Pholiota highlandensis N. scheda: 4837. Data di ritrovamento: 22/04/2012. Località: Castagneto di Senarica. Comune: Crognaleto (TE). Coordinate geografiche: 42°32'47.66"N 13°29'16.96"E. Altezza slm: 800. Habitat: Bosco di Castanea sativa, su Funaria hygrometrica e resti carboniosi. Data inserimento in erbario : 19/05/2012. t-i ***
Coprinellus bipellis N. scheda: 4840, Data di ritrovamento: 01/05/2012. Habitat: nel castagneto, fra la terra e resti carboniosi. Data inserimento in erbario: 27/05/2012. t-f
Psathyrella pennata N. scheda: 4818. Data di ritrovamento: 09/04/2012. Habitat: nel castagneto, su dei residui legnosi carbonizzati Legit: Bruno de Ruvo. Determinatore: Zugna Marino. Data inserimento in erbario: 20/04/2012. t-i ***
Ulteriori raccolte effettuate nel medesimo sito nell’arco dell’anno 2012.
Ascomycetes
Anthracobia melaloma (Alb. & Schwein.) Boud., 1893. Sul terreno, fra resti legnosi carbonizzati. 27/01. t-i ***
Octospora roxheimii var. roxheimii Dennis & Itzerott, 1973. Sul terreno, tra Funaria hygrometrica. 08/05. t-f
Peziza echinospora P. Karst., 1866. Sul terreno, fra resti legnosi carbonizzati. 08/05. t-i ***
Peziza repanda Pers. ex Pers., 1808. Tra resti legnosi non bruciati e terra, nei pressi del bruciato. 08/05. t-f ***
Peziza subviolacea Svrcek, 1977. Sul terreno, fra resti legnosi carbonizzati. 08/05. t-s ***
Plicaria carbonaria (Fuckel) Fuckel, 1870. Sul terreno, fra resti legnosi carbonizzati. 27/01. t-i ***
Pyronema omphalodes (Bull.) Sacc., 1870. Su resti legnosi carbonizzati. 08/05. t-i ***
Tricharina gilva (Boud.) Eckblad, 1968. Sul terreno, fra resti legnosi carbonizzati. 08/05. t-i ***
Basidiomycetes
Coprinellus angulatus Peck, 2001. Sul terreno, tra Funaria hygrometrica. 20/04. t-i ***
Tephrocybe ambusta (Fr. ex Fr.) Donk, 1962. Su Funaria hygrometrica e resti legnosi carbonizzati.19/05. t-i ***
Tephrocybe atrata (Fr. ex Fr.) Donk, 1962. Sul terreno, fra resti legnosi carbonizzati. 27/01. t-i ***
Conclusioni
I funghi che nascono prevalentemente in siti interessati dagli incendi, sono stati documentati più volte. Nell’arco degli anni, diversi autori, tra i quali MOSER (1989), lista 176 taxa. PETERSEN (1970), riferisce di 237 taxa. PACIONI (1987), il quale, in più anni successivi dall’incendio, lista 380 taxa. Monti et altri (1992), i quali, nell’arco del primo anno susseguente all’incendio, listano 91 taxa.Da quanto riportato sopra si riesce ad intuire quanto questo nostro lavoro sia parziale e per ora incompleto.In ogni caso, nel corso degli anni a venire, auspichiamo, per quanto nelle possibilità dell’amico Bruno de Ruvo, il continuo monitoraggio del sito in questione erborizzando eventuali nuovi ritrovamenti con i quali potremo allungare sia la nostra, per il momento corta, cecklist, sia gli eventuali contributi scritti sulle micocenosi del castagneto di Senarica.In questa nostra prima cecklist possiamo elencare 8 ascomiceti e 6 basidiomiceti per un totale di 14 taxa.Le specie reperite ad oggi nel castagneto si trovano in quasi tutte le cecklist succitate tranne una.La specie che riteniamo più interessante, in quanto poco conosciuta e mai inserita finora nelle cecklist di funghi amanti del fuoco è sicuramente Coprinellus bipellis, del quale poco si conosce e poco è stato finora scritto.Allo stato attuale delle cose, per rendersene conto, basta fare una ricerca nella bibliografia sui generis, ed eventualmente in internet, per capire che poco si sa di lui.Orbene, se con il prosieguo di questo lavoro collaborativo avremo l’occasione di aggiungere altri taxa poco noti e contribuire così alla conoscenza delle micocenosi, vorrà dire che, per poco che sia a qualcosa abbiamo contribuito.
materiali e metodi
Lo studio è stato compiuto su materiale secco, reidratato in KOH 5%.
I preparati sono stati osservati usando come mezzo di governo H2O; ove necessario, si è adoperato Rosso Congo Ammoniacale 6 % per meglio evidenziare le differenti tipologie cellulari.
Le misure microscopiche sono state eseguite con il software di calcolo Mycométre gentilmente fornitoci dal Sig. Georges Fannechère e prelevabile al seguente indirizzo http://mycolim.free.fr.
Le misure sporali si riferiscono a 100 unità, effettuate in proiezione laterale senza tener conto dell’apiculo, prelevate da zone non imeniali, scartando spore ancora evidentemente immature, per le rimanenti tipologie cellulari si sono eseguite un minimo di venti misure a tipologia.
Per la terminologia riguardante la tipologia delle caratteristiche macro e microscopiche, si fa riferimento a Else C. Vellinga1998: Flora Agaricina Neerlandica 1- Chapter 8; Glossary.
Per quanto riguarda la nomenclatura aggiornata ed i nomi degli Autori, abbiamo fatto riferimento a http://www.indexfung...names/Names.asp e http://www.mycobank.org/MycoTaxo.aspx .
Per le osservazioni dei caratteri macroscopici, in alcuni casi, ci siamo valsi di uno stereo microscopio Optech trinoculare. Le foto delle raccolte sono state effettuate in Habitat dal Legit, con l’ausilio di una fotocamera Nikon D3 e obiettivo Nikkor micro 60.
Le microfotografie, sono state eseguite dall’Autore dell’articolo, con l’ausilio di una fotocamera Reflex EOS 50D posto sul terzo occhio di un microscopio biologico Optech Biostar B5, supportato da ottiche Plan-APO, illuminazione alogena 12V-50 W a luce riflessa, con regolatore d'intensità.
Le collezioni d’erbario sono conservate nell'erbario A.M.B. Gruppo di Muggia e del Carso.
Coprinellus bipellis
(Romagn.) P. Roux, Guy García & Borgarino, in Roux, Mille et Un Champignons: 13 (2006)
Basionimo: Coprinus bipellis Romagn., Bull. trimest. Soc. mycol. Fr. 92: 198 (1976)
Sinonimi: Coprinus bipellis Romagn., Bull. trimest. Soc. mycol. Fr. 92: 198 (1976)
Posizione sistematica: Agaricaceae, Agaricales, Agaricomycetidae, Agaricomycetes, Agaricomycotina, Basidiomycota, Fungi
Original description: Coprinus bipellis Romagnesi, H. 1976. Espèces rares de macromycètes 1. In Bull. Soc. myc. Fr. 92: 199. Diagnose Latine. - A C. radiante differt velo eximie cohaerenti, semimembranaceo, comparate crasso, sericeo, pallido, totam superficiem pilei occultante, fibrillis rufis insuper vestito. Stipite bulboso, albo, pruinoso. Sporis subopacis, 8.5-10.5 x 4.5-5.2 µm, anguste ellipsoideis, interdum paulum phaseoliformibus, poro manifestissimo. Basidiis 4-sporis. Cystidiis globosis vel ellipsoideis, ad 115 x 60 µm. - Loco ambusto, Luzarches (V.-d'O.). Typus: no. 5, 10 mai 1946.
quadro macroscopico della raccolta
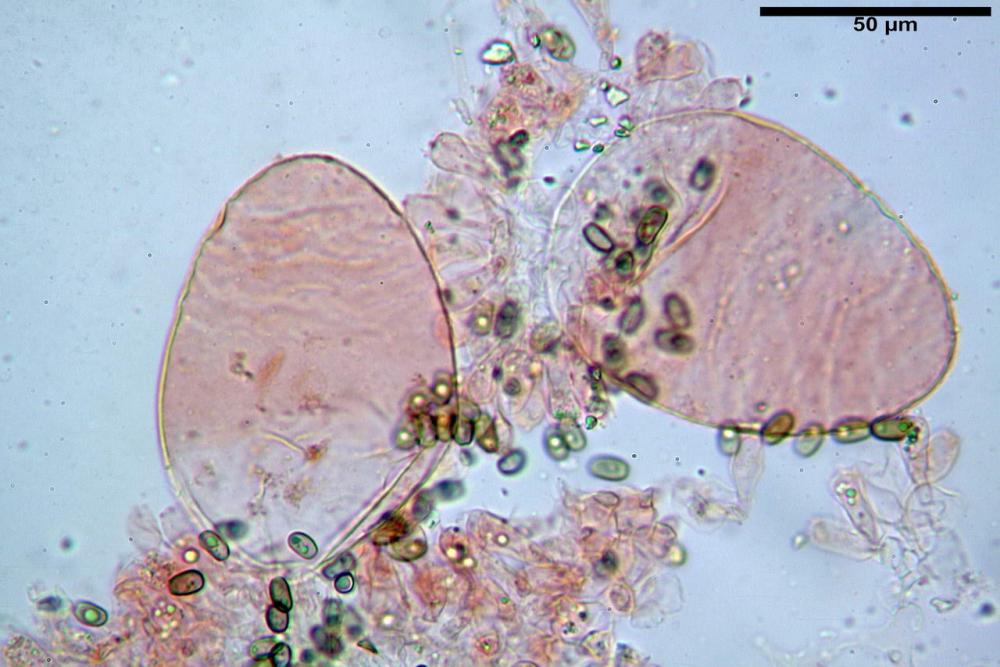
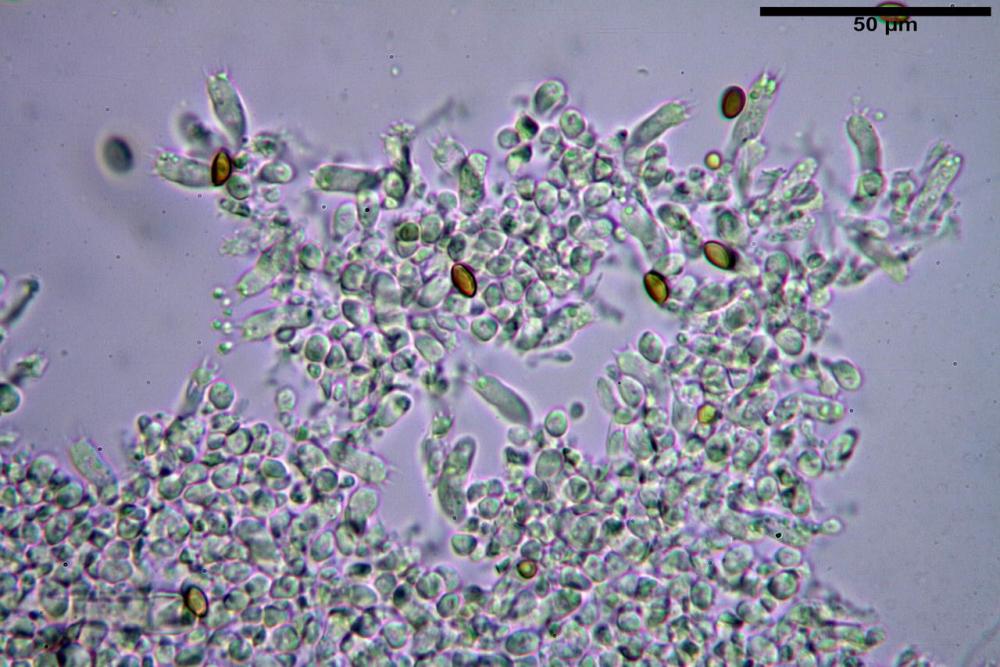
La raccolta si riferisce ad un gruppetto di otto esemplari, in diversi stadi di crescita. Basidiomi piuttosto tozzi nonostante le piccole dimensioni; di forma coprinoide, con carne esigua nel pileo e abbastanza consistente nello stipite.
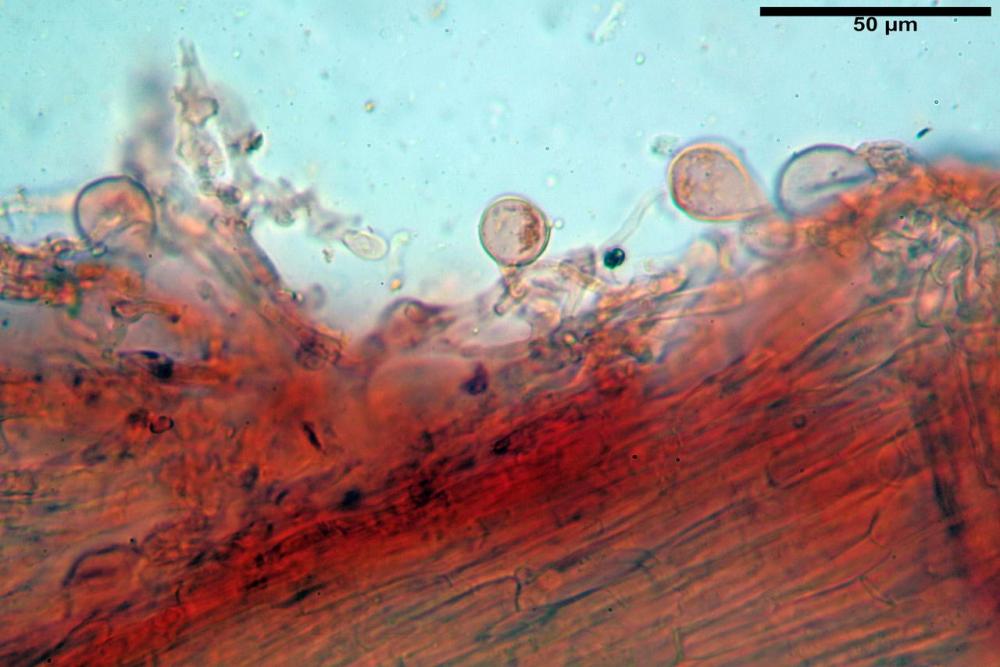
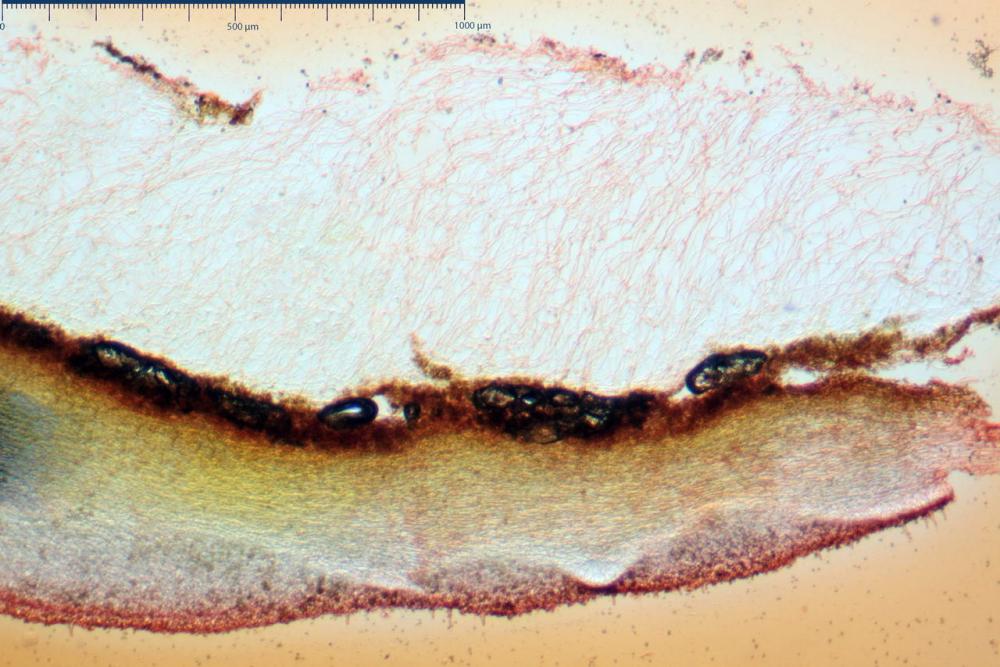
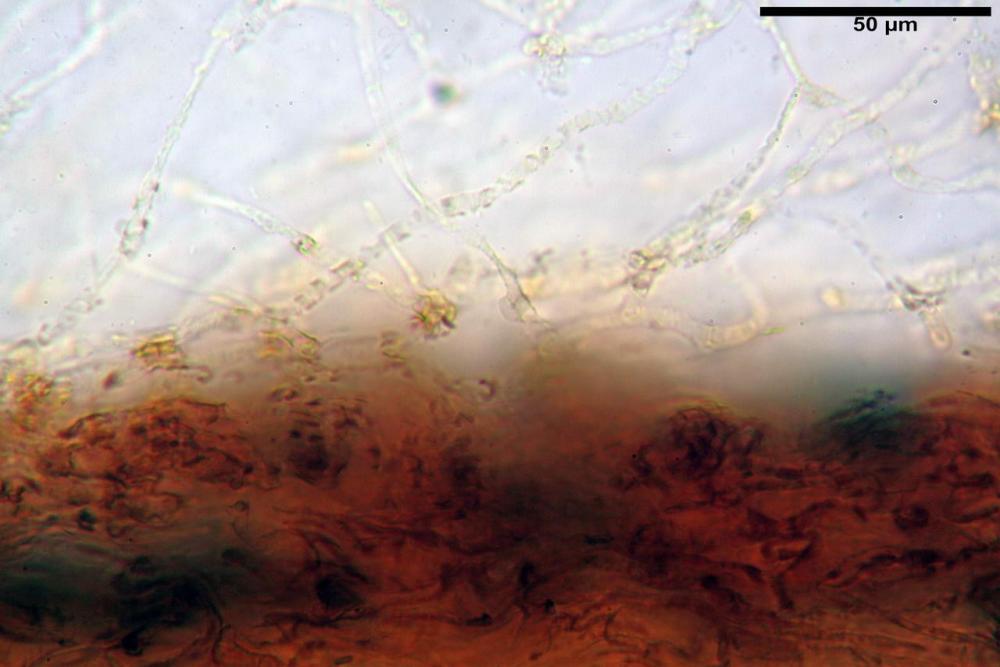
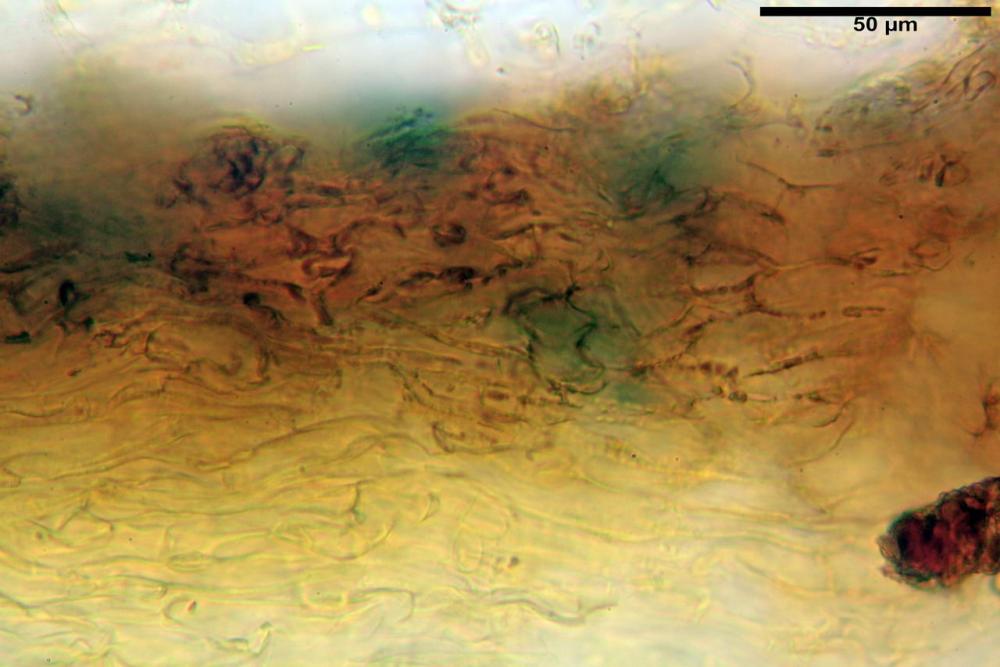
Velo membranoso, di colore giallo-ocra-arancio. Abbondantissimo. Nei giovani esemplari a ricoprire l’intero basidioma. Presto fratturato a livello della porzione basale, dove, buona parte rimane a formare la pseudo volva, mentre la parte superiore rimane aderente alla superficie pileica sotto forma di placche membranacee, più o meno ampie e di lembi appendicolati al margine.
Pileo alto 10-30 mm, largo 10-20 mm, all’inizio emisferico, presto ovoide, velocemente campanulato, infine disteso con o senza basso umbone ottuso. Superficie pileica fortemente plissettata per gran parte del raggio fuori che al disco; di colore uniformemente ocraceo, più intenso al disco.
Lamelle libere, ventricose, molto fitte, intercalate da lamellule. All'inizio di colore bianco, presto rosate, quindi rosa-grigiastre, ed infine nere; filo lamellare, all’inizio concolore, appena più chiaro in corso di maturazione.
Stipite 30-70 x 3-5 (10) mm, diritto, ristretto in alto, via via più largo verso il basso, terminante in un piccolo bulbo rivestito da una fitta peluria feltrosa, a formare una pseudo volva, quasi membranosa, di colore giallo-ocra-arancio, avvolgente il bulbo e la porzione basale dello stipite. Finemente pruinoso in gran parte della superfice, più o meno liscio verso il basso. Completamente di colore bianco candido, accidentalmente macchiato di bruno in basso.
Carne scarsa e ocracea nel pileo, bianca e piuttosto consistente nello stipite lentamente deliquescente,. Insapore nel exsiccatum. Odore non testato.
quadro microscopico della raccolta
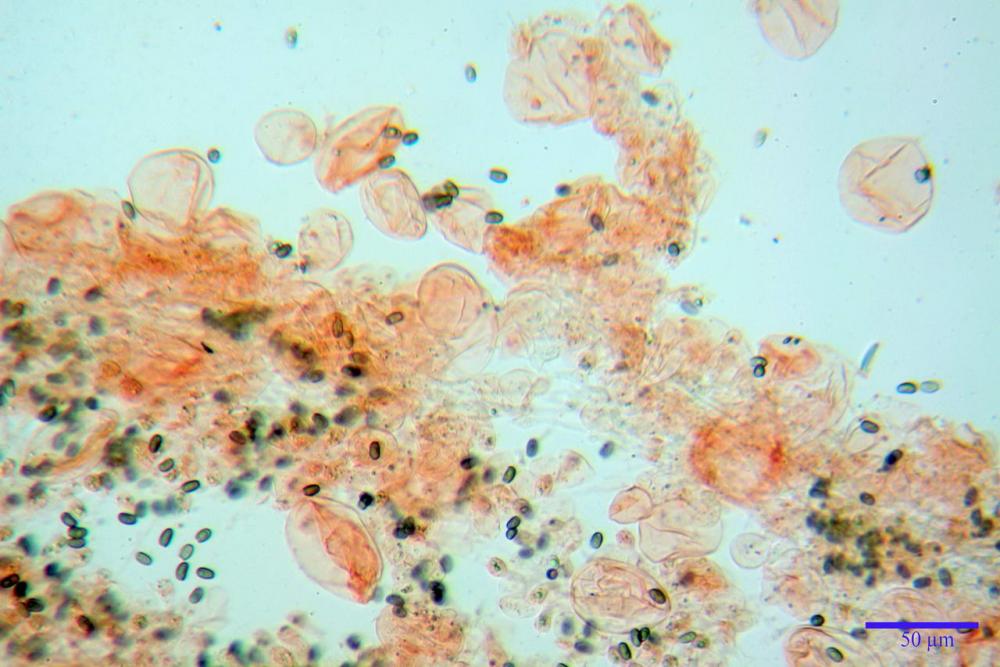
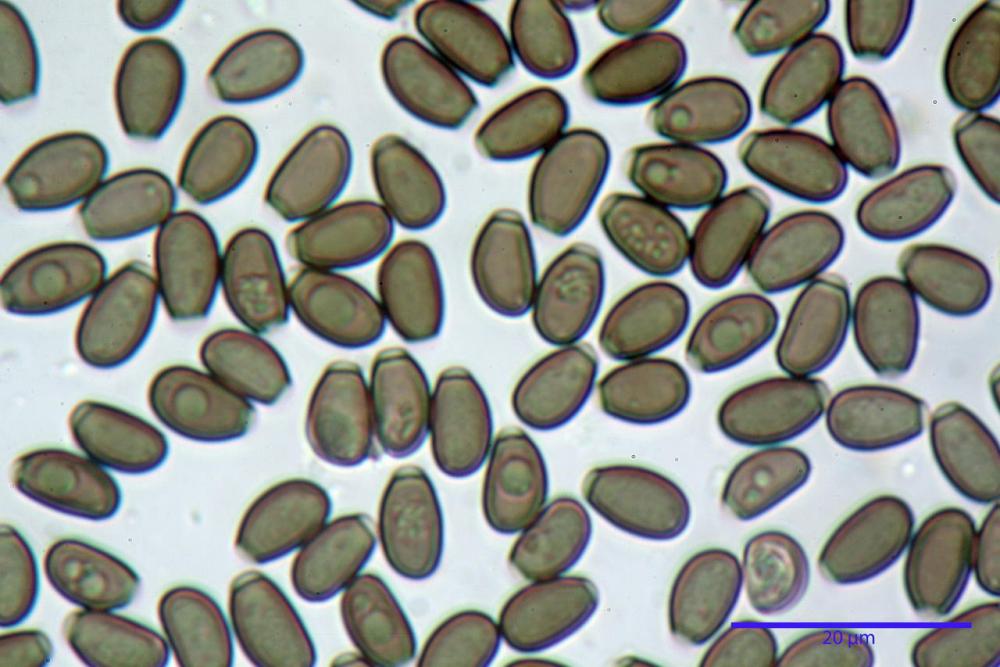
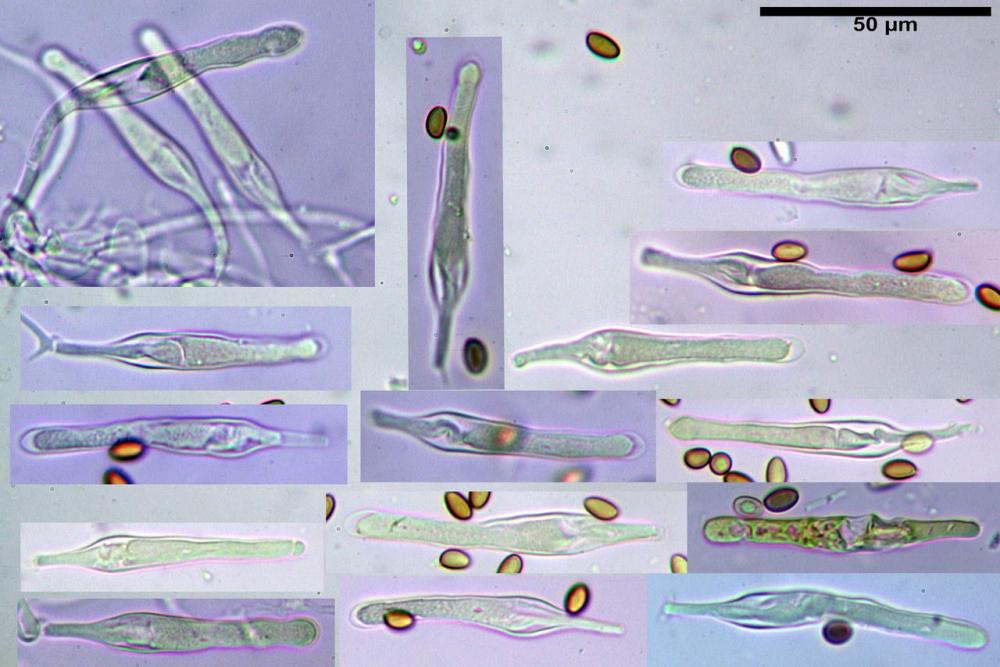
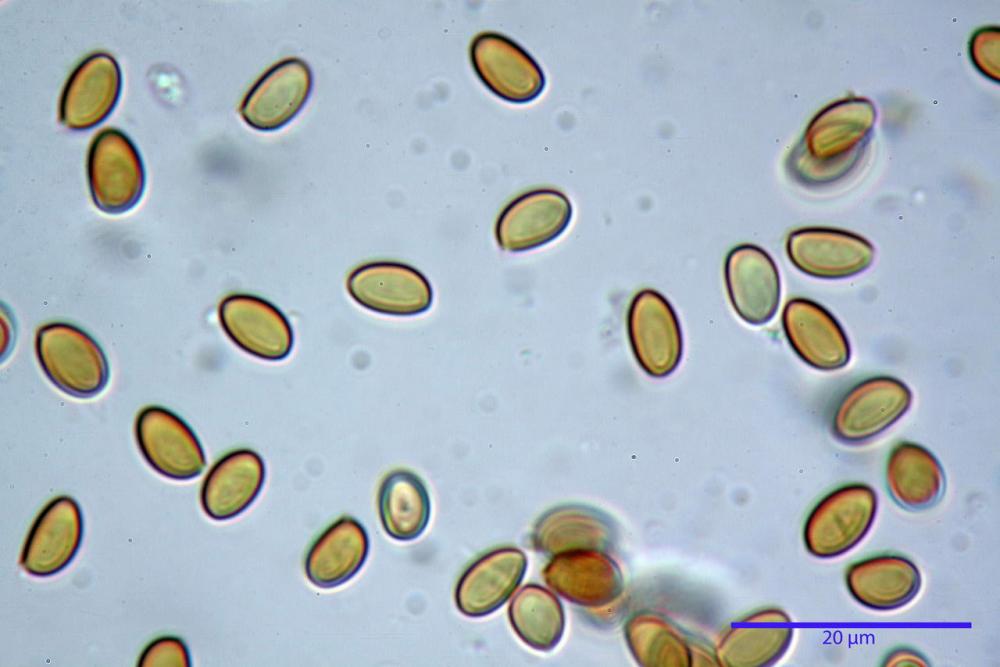
Spore ellissoidali in proiezione laterale (7,6) 8,2-9,2 (9,8) x (4,6) 4,8-5,4 (5,6) µm, in media 8,78 x 5,12 µm; Q. = (1,5) 1,6-1,8 (1,9), Q.m.= 1,76; Vol. (94) 103-140 (152) µm³, Vol.m.= 121 µm³; ovoidi in proiezione frontale, ellissoidi in proiezione laterale, con apice evidentemente tronco e poro germinativo centrale, in qualche caso leggermente eccentrico, con diametro di 1,2-2,2 µm, in media 1,80 µm; base da arrotondata a più o meno conica, apicolo poco visibile, ialino, parete spessa 0,5-0,8 µm, in media 0,72 µm, al microscopio ottico di colore marrone-rossastro, nere nella polvere sporale.
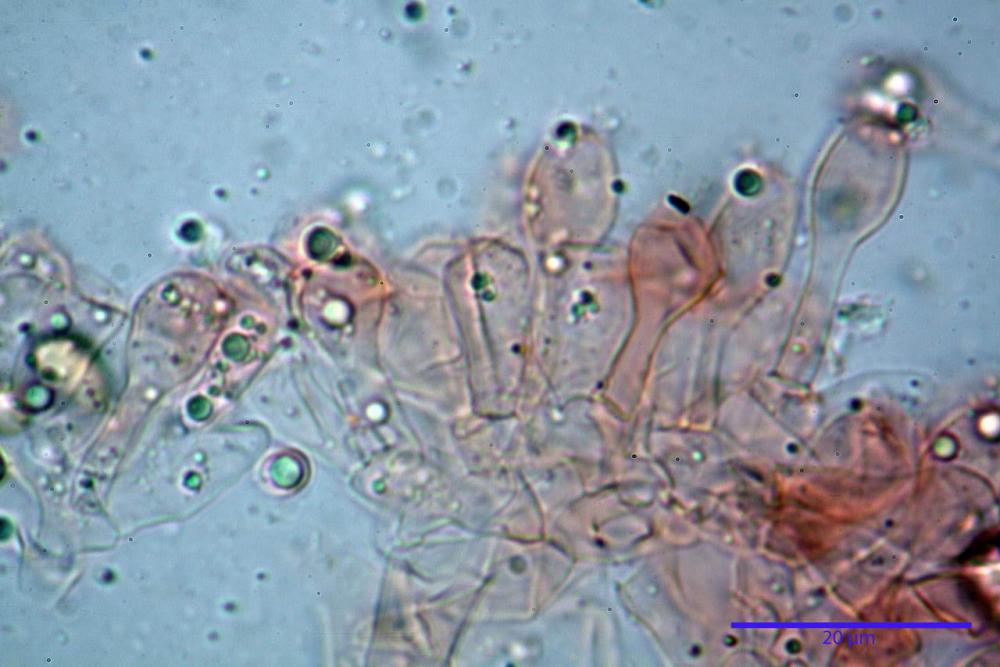
Basidi (16) 17-25 (26) x (6) 7-8 (9) µm, in media 21,4 x 7,5 µm; Q.m.= 2,87; Vol.m.= 636 µm³, tetrasporici, in massima parte clavato- pedicellati senza restringimento mediano, più raramente semplicemente clavati. Contornati da 4-5 pseudoparafisi di forma sferopeduncolata.
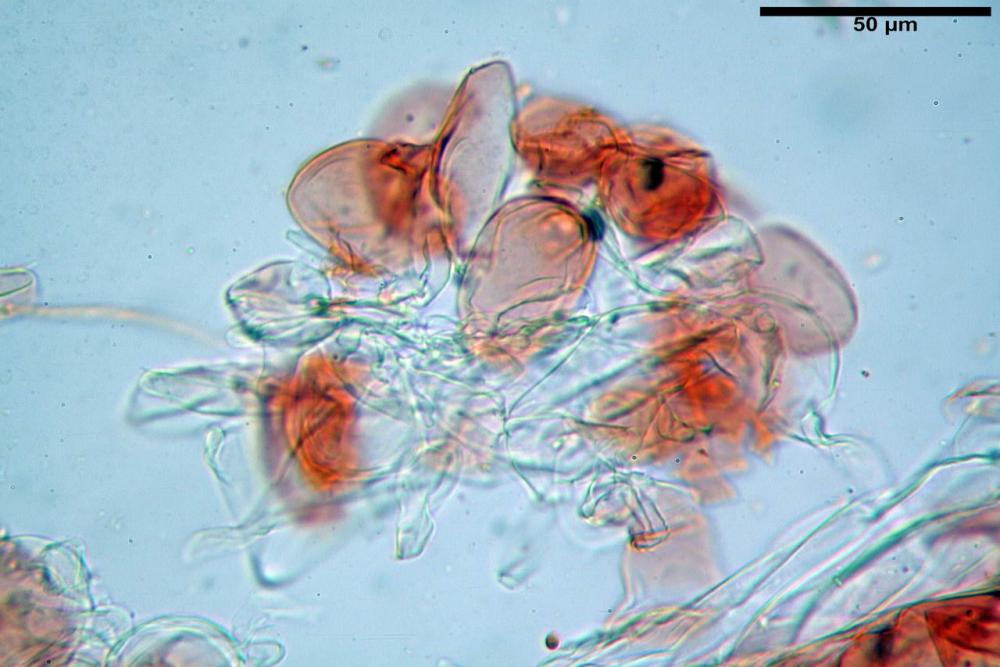
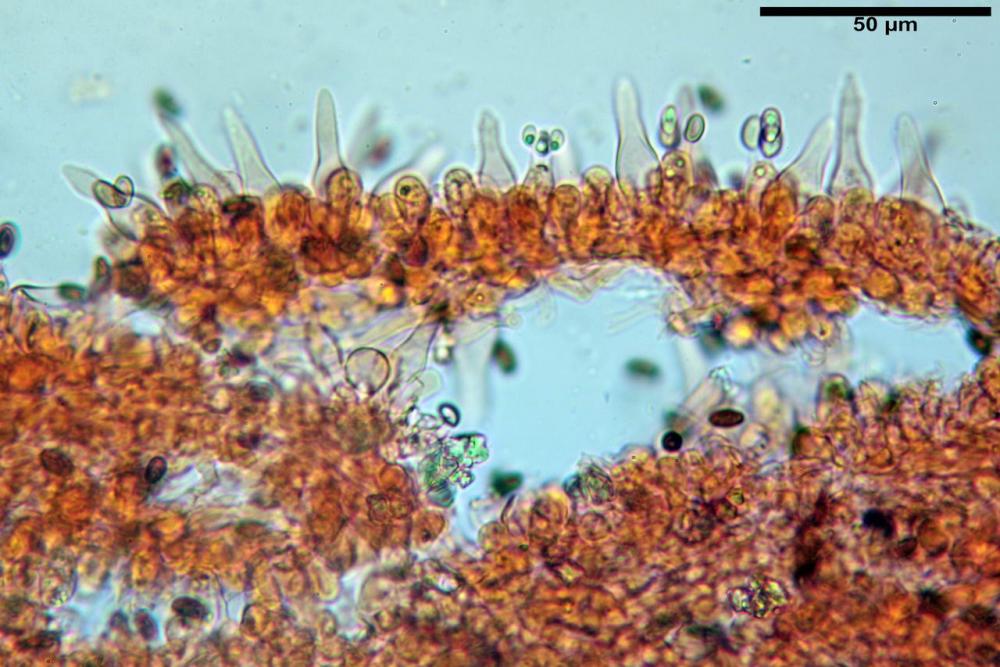
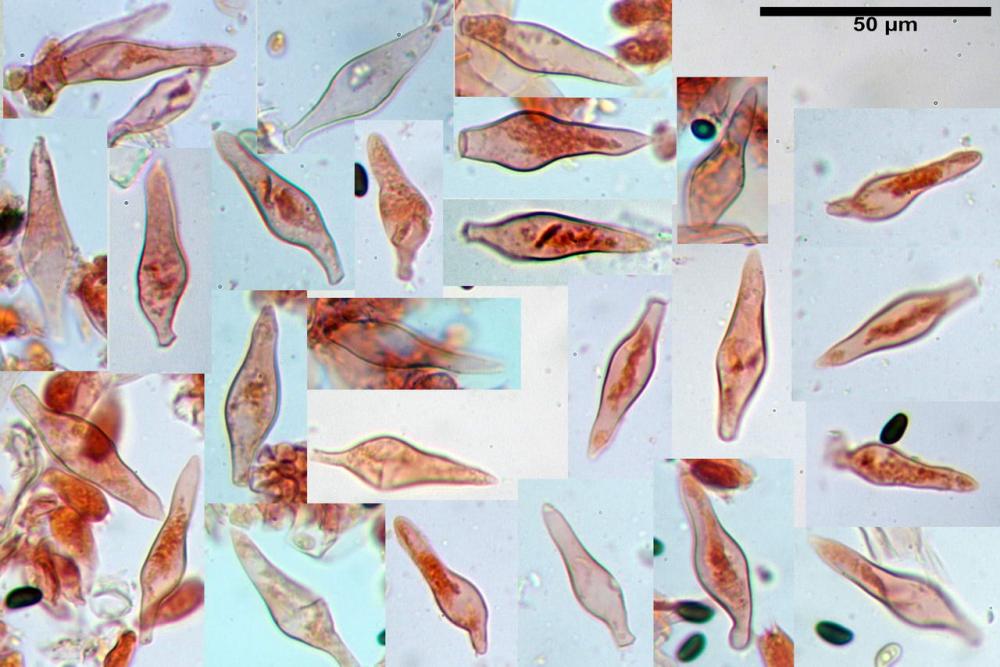
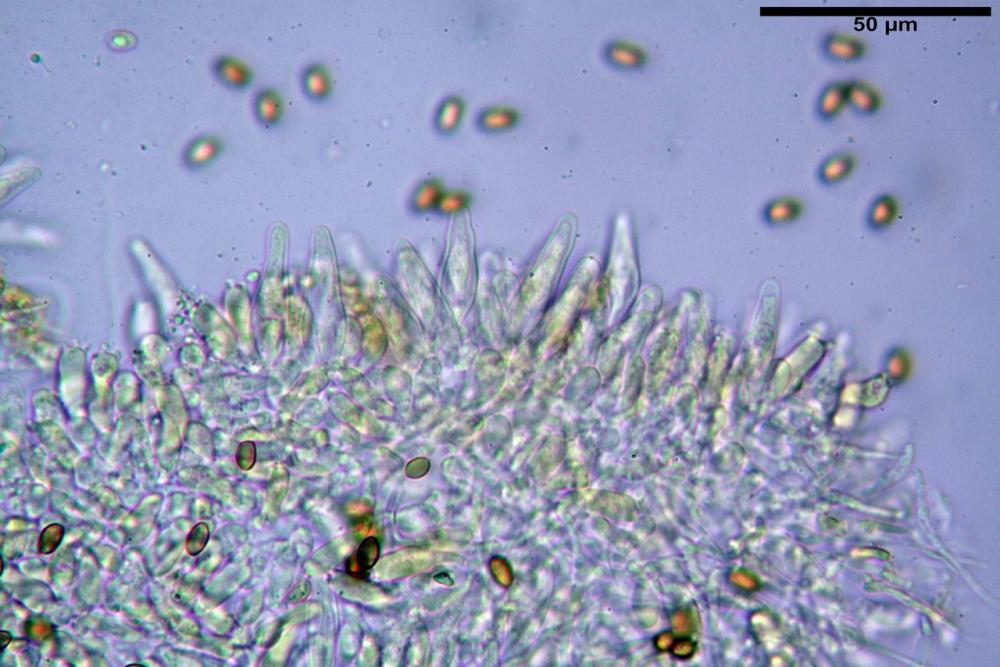
Cheilocistidi (23) 32-55 (64) x (25) 27-46 (48) µm, in media 44,8 x 36,9 µm, Q.m.= 1,23; Vol.m.= 34194 µm³; numerosi in massima parte da globosi o subglobosi, spesso attaccati ad un ifa più o meno lunga, più raramente subutriformi con breve pedicello ma privi di ifa, per buona parte (soprattutto quelli globosi), immersi nell’imenio. Filo lamellare (probabilmente eteromorfo?), in quanto abbiamo notato numerose zone dove i cheilocistidi erano molto addensati e profondamente insinuati nell’imenio ed altre dove essi erano radi e frammisti a basidi o addirittura mancavano completamente. Questo potrebbe far supporre un loro repentino distacco in fase di crescita e ciò darebbe un senso alla loro numerosa presenza sullo stipite.
Pleurocistidi (72) 75-100 (104) x (40) 42-67 (73) µm, in media 89,5 x 59,3 µm, Q.m.= 1,53 ; Vol.m.= 169961 µm³; da ovoidi a largamente utriformi, molto numerosi.
Nota: cheilocistidi e pleurocistidi di tipologia lageniforme non osservati.
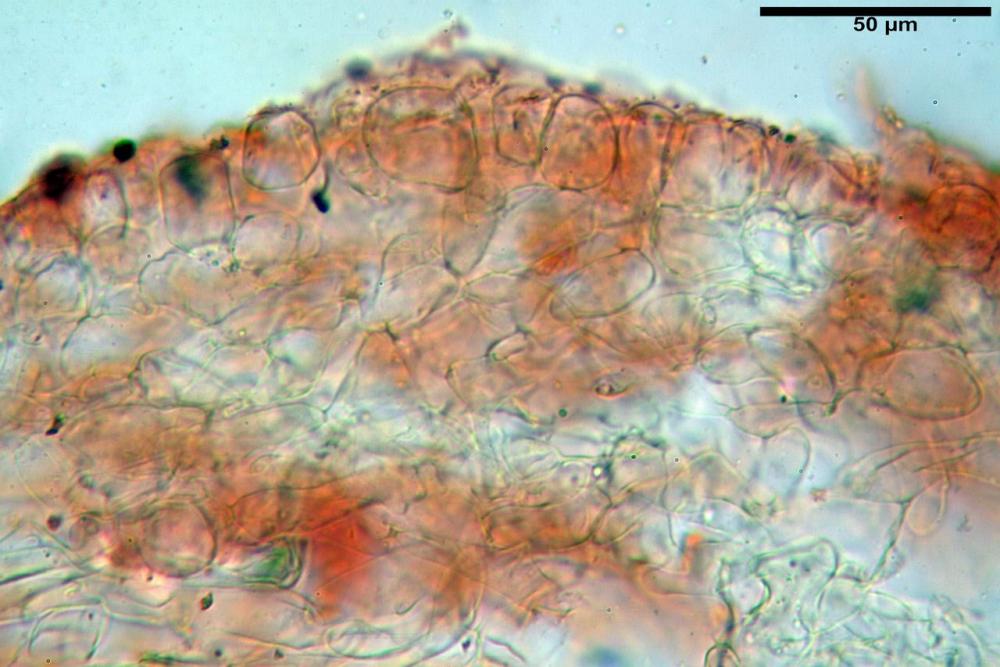
Pileipellis di tipo epithelium (12) 14-23 (26) x (11) 12-23 (25) µm, in media 19,3 x 17,0 µm, Q.m.= 1,17; Vol.m.= 3304 µm³, formata da cellule subglobose. Pileocistidi assenti.
Caulopellis disposta in cutis, formata da ife cilindriche, settate, misuranti di diametro 3-8 µm, le più esterne leggermente gelatinizzate e ricoperte da granulosità. Quelle interne 5-14 µm, ialine.
Caulocistidi globosi o subglobosi, misuranti (13) 16,48-28 (31) x (12) 13-22 (28) µm, in media 21,9 x 17,9 µm. Vol.m.= 3969 µm³, molto simili ai cheilocistidi, il che, potrebbe far supporre che, nelle prime fasi di sviluppo, una buona parte dei cheilocistidi distaccandosi dall'imenio, rimangano appiccicati alle ife corticali dello stipite e forse per questo motivo, nonostante il filo lamellare discolore, indichi la presenza di cheilocistidi, poi, in realtà non ci si trovino che pochi esemplari. Caulocistidi lageniformi (setae) non osservati.
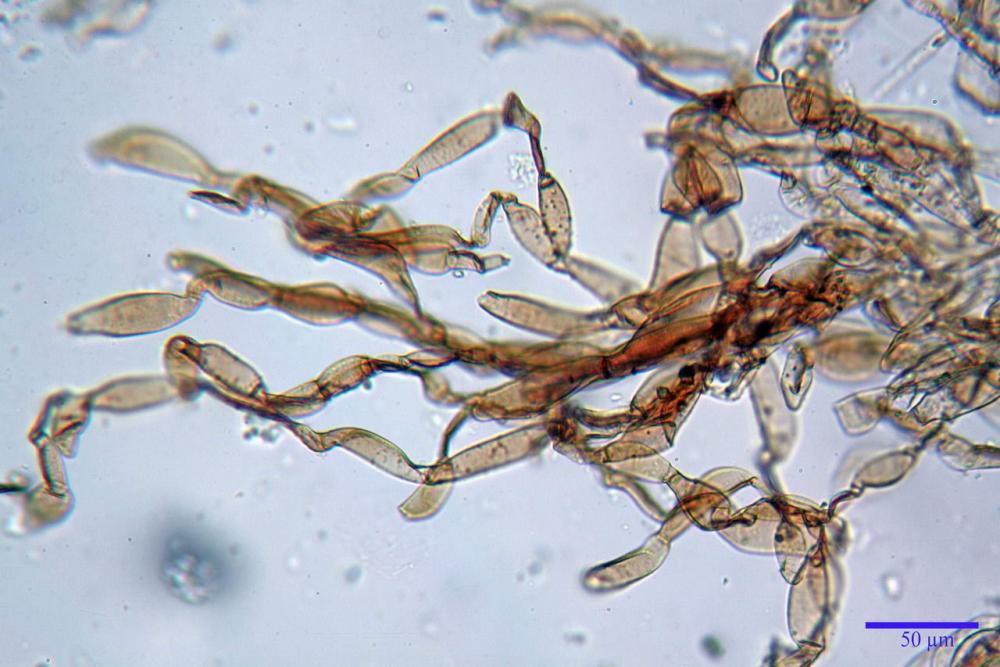
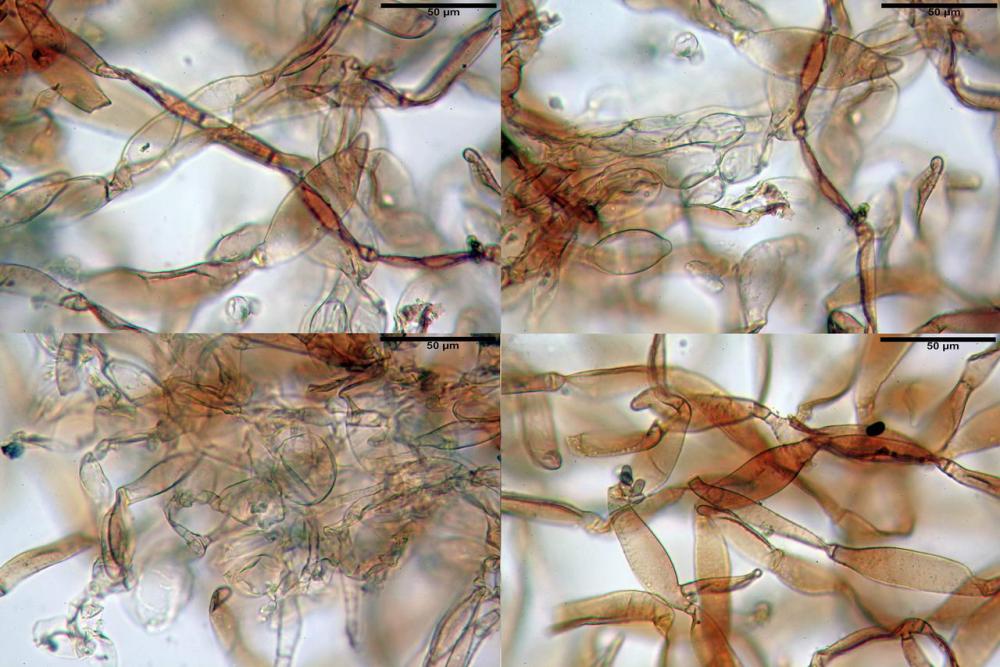
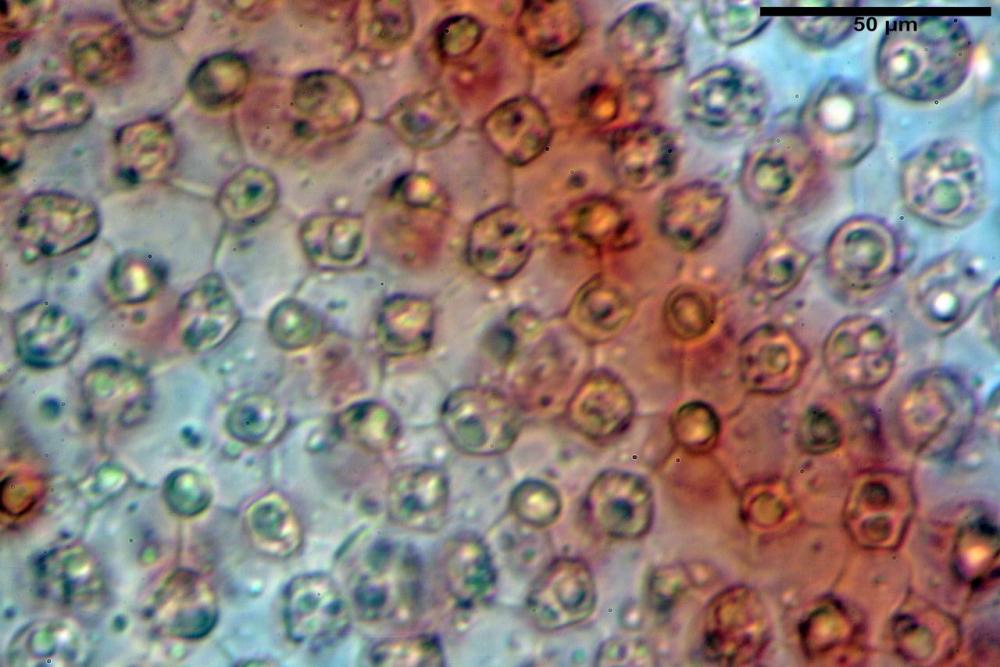
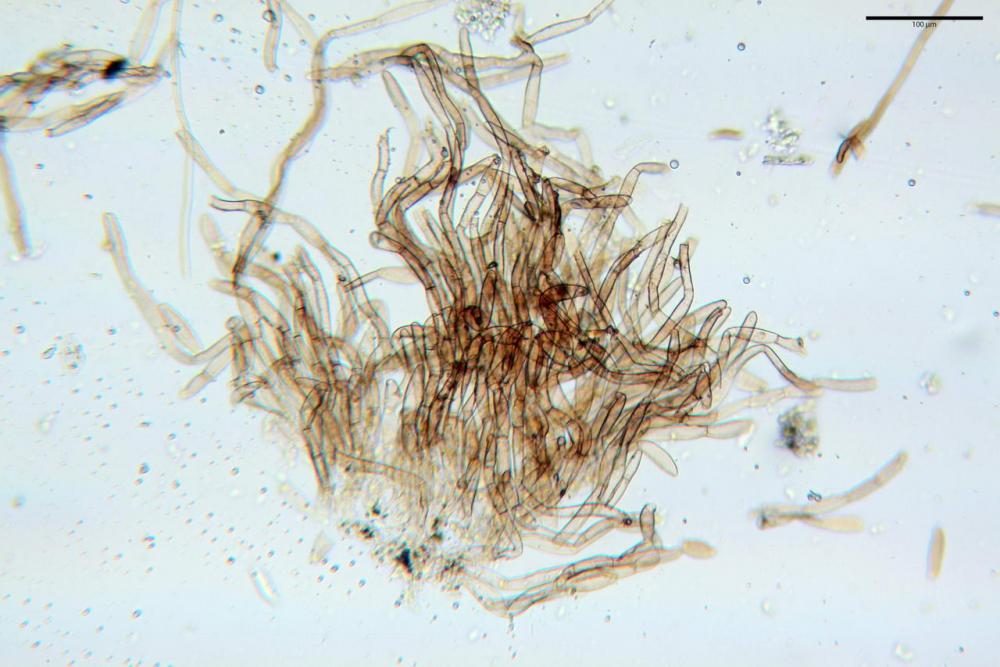
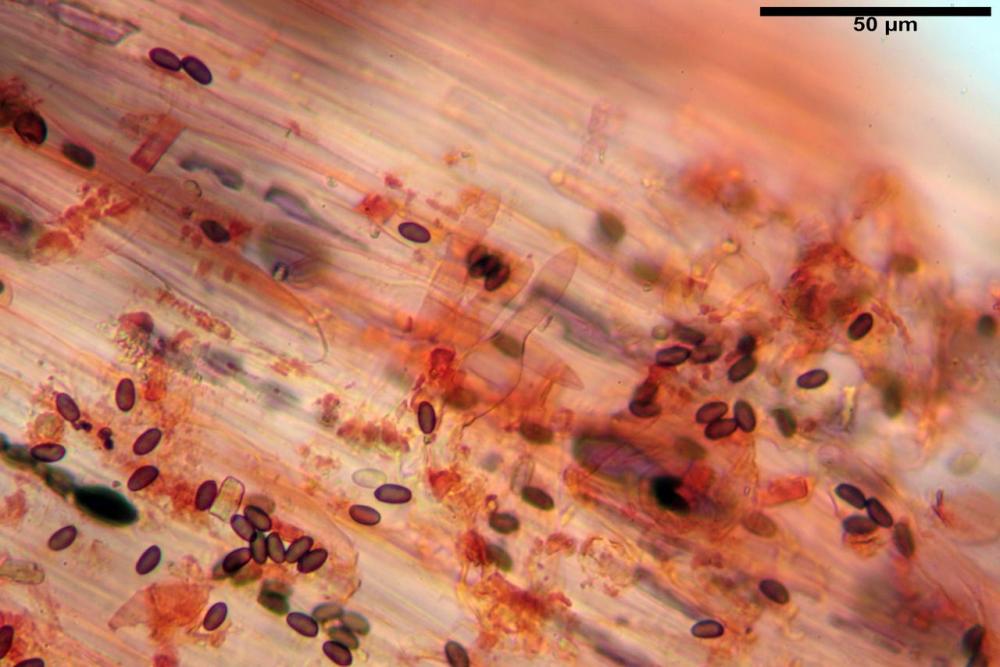
Velo pileico formato per la quasi totalità da ife con pigmento parietale bruno, cilindriche e ristrette ai setti, catenulate con articoli misuranti (27) 33-68 (71) x (9) 11-17 (18) µm, in media 50,9 x 14,7 µm, Vol.m.= 6075 µm³. Articoli terminali con pigmento parietale bruno o ialini, fusiformi e attenuati all'apice, misuranti (39) 43-68 (72) x (14) 16-23 (25) µm, in media 56,3 x 19,8 µm, Vol.m.= 12737 µm³. Parete spessa < 1,0 µm. Cellule globose molto scarse (18) 23-29 (30) µm, ialine.
Velo della base (pseudovolva), formato da ife con pigmento parietale e incrostante bruno, cilindriche, raramente ristrette ai setti, catenulate, con articoli misuranti (28) 30-51 (54) x (7) 8-10 (11) µm, in media 37,0 x 9,1 Vol.m.= 1651 µm³. Articoli terminali con pigmento parietale bruno, da cilindrici attenuati all'apice a fusiformi, misuranti (23) 24-68 (69) x (8) 9-14 (15) µm, in media 45,8 x 11,5 µm, Vol.m.= 3434 µm³. Cellule globose non osservate.
Giunti a fibbia assenti in tutte le parti dei basidiomi prese in esame.
Osservazioni
Coprinellus bipellis si riconosce per il suo velo particolare, ed i sui vistosissimi residui, giacenti a lungo sulla pileica sotto forma di vistose placche e molto spesso alla base dello stipite a simulare una pseudovolva.
Nel nostro studio, in relazione ai caratteri microscopici, abbiamo notato la totale assenza di caulocistidi di tipologia lageniforme, la dove, nelle rimanenti specie appartenenti al gruppo dei domestici (a parte C. flocculosus), abbiamo sempre riscontrato la loro presenza o sul filo lamellare, o sullo stipite o in entrambe le superfici. Anche le spore hanno riservato alcune particolarità riguardanti soprattutto il poro germinativo che, nel nostro caso si è dimostrato sempre molto ampio, tronco con la membrana rigonfia, ma soprattutto totalmente centrale in tutte le spore da noi osservare (alcune centinaia).
la Sezione Veliformes (Fr.) Penn., Sottosezione Domestici Sing., oltre alla specie in oggetto di studio, comprende altri cinque taxa di cui diamo un breve cenno.
C. ellisii (P.D. Orton) Redhead, Vilgalys & Moncalvo, molto prossimo e spesso confuso con la specie in oggetto, si caratterizza principalmente per avere spore di taglia notevolmente inferiore, caulocistidi lageniformi.
C. xanthothrix (Romagn.) Vilgalys, Hopple & Jacq. Johnson, presenta spore, solo in alcuni casi, faseoliformi viste di profilo è possiede cheilocistidi e caulocistidi anche di tipologia lageniforme.
C. domesticus (Bolton) Vilgalys, Hopple & Jacq. Johnson, presenta spore, per la quasi totalità, faseoliformi viste di profilo, caulocistidi anche di tipologia lageniforme.
C. radians (Desm.) Vilgalys, Hopple & Jacq. Johnson, possiede spore che possono arrivare a 11,5 µm, inoltre, cheilocistidi e caulocistidi anche di tipologia lageniforme.
C. flocculosus (DC.) Vilgalys, Hopple & Jacq. Johnson, possiede spore 11-16 x 6.5-9.5 µm, con poro germinativo fortemente eccentrico e assenza di caulocistidi.
Anche l’habitat carbonicolo può, in qualche modo, venire in aiuto e restringere il campo d’ipotesi. I coprini carbonicoli o amanti di questo substrato non sono poi molti, ed in ogni caso, le loro differenze sostanziali sono abbastanza riguardevoli.
Di questi, proviamo a dare una breve lista riassuntiva senza per altro pensare che possano essere solo questi i coprini che, in un modo o nell’altro possano crescere in luoghi combusti.
Coprinopsis phlyctidospora (Romagn.) Redhead, Vilgalys & Moncalvo, possiede spore verrucose.
Coprinopsis erythrocephala (Lév.) Redhead, Vilgalys & Moncalvo (= C. dilectus ss. Lge.), possiede basidiomi con velo di un rosso corallo molto appariscente.
Coprinopsis lagopides (P. Karst.) Redhead, Vilgalys & Moncalvo (= C. lagopus var. sphaerosporus Kühn. & Joss., C. funariorum Métr., C. jonesii Peck), possiede spore subglobose, lenticolari, 9 x 7 x 6 µm
Coprinopsis gonophylla (Quél.) Redhead, Vilgalys & Moncalvo, possiede spore appiattite 8 x 6 x 4 µm, e il velo ramificato.
Parasola auricoma (Pat.) Redhead, Vilgalys & Hopple (= C. crenatus ss. Rick., C. hansenii L.ge.?), possiede spore 12-14 x 7 µm, superfice pileica con lunghi peli a parete spessa (setae).
Coprinellus angulatus (Peck) Redhead, Vilgalys & Moncalvo (= C. boudieri ), possiede spore mitriformi 10 x 8 x 6 µm, velo assente.
Le descrizioni che si possono trovare nella bibliografia sui generis riguardo a C. bipellis, non sono poi molte, inoltre, spesso contrastano tra di loro (anche nel caso si tratti dello stesso Autore), e spesso non aiutano a delimitare in modo chiaro il taxon.
Con questo breve lavoro speriamo di aver aggiunto qualche nota ad un taxon che, nelle letteratura moderna trova poche e succinte descrizioni. Rendendoci conto che, quando si ha a che fare con il genere Coprinus sl., per le caratteristiche proprie di questo deliquescente ed effimero genere, spesso non si è in grado di affinare la ricerca.
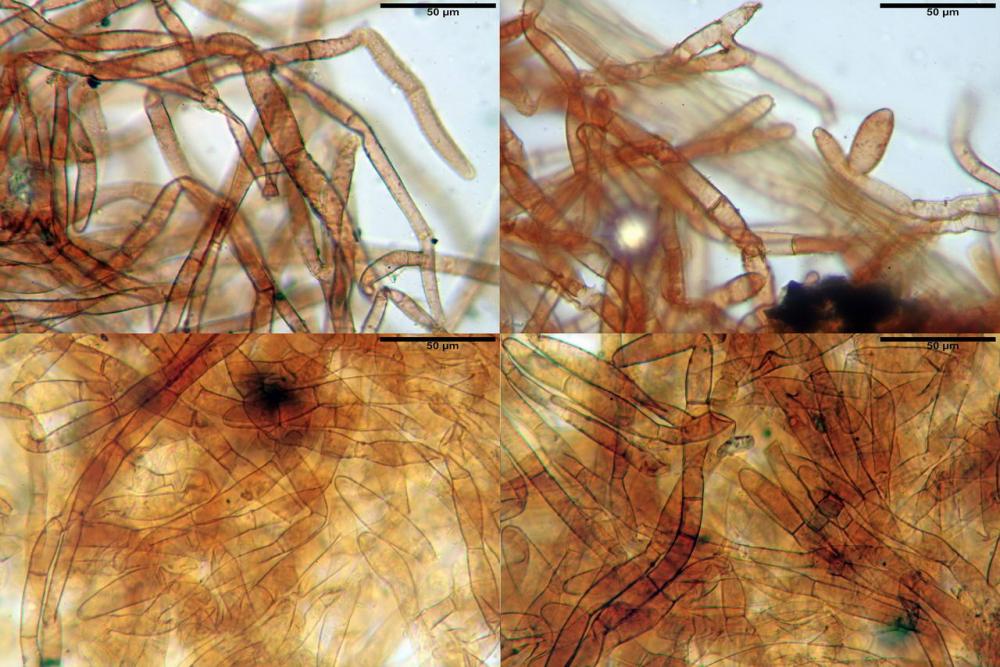
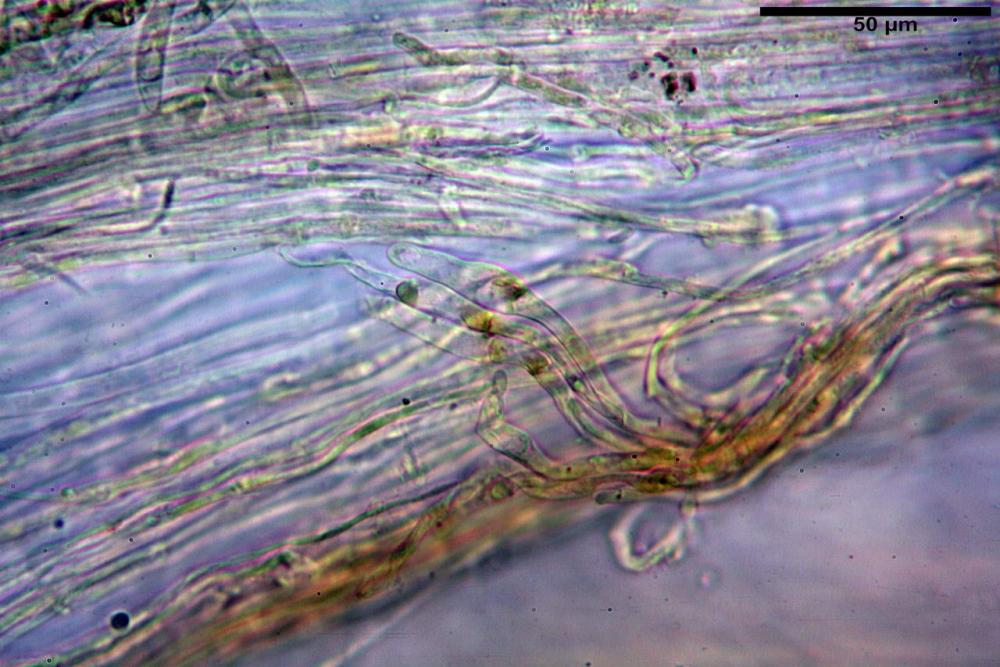
velo pileico
velo pileico



 Questa discussione è bloccata
Questa discussione è bloccata